
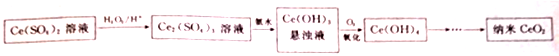
分析 Ce(SO4)2溶液在酸性溶液中与过氧化氢反应,被还原成Ce2(SO4)3溶液,Ce2(SO4)3溶液中加入氨水生成Ce(OH)3沉淀,通入氧气氧化得到Ce(OH)4,分解得到CeO2,
(1)过氧化氢还原高铈硫酸盐得到硫酸铈溶液;用硫酸酸化不会引入新的杂质;
(2)氧化过程中Ce(OH)2沉淀通入氧气氧化得到Ce(OH)4,氧气为氧化剂,Ce(OH)2沉为还原剂,依据电子转移守恒计算氧化剂和还原剂物质的量之比;
(3)制备的CeO2是否为纳米级,溶于水利用胶体的丁达尔效应检验;
(4)①实验中大约需要210~240mL该标准溶液,所以配制溶液时可配制250mL;
②配制溶液时,溶解固体应在烧杯中进行;
③配制的溶液为250mL,所以可选用250mL的容量瓶,据此答题;
解答 解:Ce(SO4)2溶液在酸性溶液中与过氧化氢反应,被还原成Ce2(SO4)3溶液,Ce2(SO4)3溶液中加入氨水生成Ce(OH)3沉淀,通入氧气氧化得到Ce(OH)4,分解得到CeO2,
(1)过氧化氢还原高铈硫酸盐得到硫酸铈溶液;用硫酸酸化不会引入新的杂质,所以用硫酸酸化,
故答案为:将高铈硫酸盐还原;硫酸;
(2)氧化过程中,4Ce(OH)3+2H2O+O2=4Ce(OH)4,氧化剂与还原剂的物质的量之比为1:4,
故答案为:1:4;
(3)检验制备的CeO2是否为纳米级的方法是利用胶体的特征性质,将产品分散至水中,用一束强光照射,若产生丁达尔效应,则制备的CeO2为纳米级,
故答案为:用一束强光照射,若产生丁达尔效应,则制备的CeO2为纳米级;
(4)①实验中大约需要210~240mL该标准溶液,所以配制溶液时可配制250mL,此时需要的(NH4)2Fe(SO4)2的质量为0.1000mol/L×0.25L×284g/mol=7.1g,
故答案为:7.1;
②配制溶液时,溶解固体应在烧杯中进行,
故答案为:烧杯;
③配制的溶液为250mL,所以可选用250mL的容量瓶,
故答案为:250mL.
点评 本题考查了物质组成和成分的探究、物质的分离提纯方法、溶液配制的过程分析和计算等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
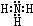 ,B的结构式为
,B的结构式为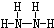 .
. .
.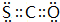 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
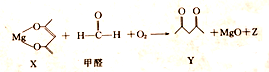
| A. | X 是还原剂 | B. | Y的分子式为C5H8O2 | ||
| C. | Z的摩尔质量为44g | D. | 除去1mol甲醛时,转移2mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下使氢成为二次能源 | |
| B. | 寻找优质催化剂,使CO2与H2O反应生成CH4和O2,并放出热量 | |
| C. | 寻找优质催化剂,利用太阳能使大气中的CO2和海底开采的CH4合成合成气(CO、H2) | |
| D. | 将固态碳合成C60,以C60作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸比磷酸易挥发 | |
| B. | 金刚石的熔点比晶体硅高 | |
| C. | 惰性气体一般很难发生化学反应 | |
| D. | 通常情况下单质溴呈液态、碘呈固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
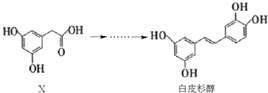
| A. | X的分子式为C8H10O4 | |
| B. | 化合物X、白皮杉醇均可与Na2CO3溶液反应并放出气体 | |
| C. | 白皮杉醇与浓溴水反应时,最多可消耗6 mol Br2 | |
| D. | 在一定条件下,白皮杉醇可发生加成、取代、氧化和聚合反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com