
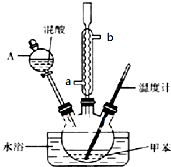
 ijʵ��С������ͼ��ʾ��װ���Ʊ�һ�����ױ������������ױ��Ͷ������ױ�����
ijʵ��С������ͼ��ʾ��װ���Ʊ�һ�����ױ������������ױ��Ͷ������ױ�����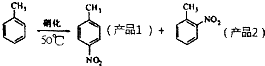
| �ܶ�g•cm-3 | �е�/�� | �ܽ��� | |
| �ױ� | 0.866 | 110.6 | ������ˮ�������������ױ� |
| ��Ʒ1 | 1.286 | 237.7 | ������ˮ��������Һ���� |
| ��Ʒ2 | 1.162 | 222 | ������ˮ��������Һ���� |

���� �Ʊ�һ�����ױ��������ƻ����Һ�������ᣩ��20mL����ӦҺ��е�ϵͣ�����ʱ���������У�����������ƿ�м����ʯ��Ȼ�����10ml�ױ����ӷ��е�Ϊ110.6�棩����������ƿ�м�����ᣬˮԡ��ˮ�ķе�100�棩Ŀ���ܾ��ȼ��ȣ��ұ��ڿ��Ʒ�Ӧ���ʣ��¶�ԼΪ50�棬��Ӧ��Լ10min������ƿ���д�������ɫ��״Һ����֣�����һ���������ﶼΪ�л������ֻ���������Ƿе�IJ�ͬ��������ķ������룬���ᴿ���յõ�������һ�����ױ���
��1�������Һ�����ƿɲ���Ũ�����ϡ�ͣ�
��2���Ʊ�һ�����ױ���Ũ�������������÷�ӦΪ���淴Ӧ��Ũ������ˮ����ƽ��������һ�����ױ������ƶ���
��3������A�Ƿ�Һ©����ʹ��ǰ�������Ƿ�©Һ��
��4����Ϊ��������һ����������ֻ���������Ƿе�IJ�ͬ����˲�������ķ�����ʹ�õ����ṩ�����еķֱ��ǣ��ƾ��ơ��¶ȼơ������ܣ�
��5�����ʵļ��㷽��������ʵ�ʲ����������۲�������駷���ʽ��һĦ���ļױ����Եõ�һĦ���Ķ������ױ���һĦ�����������ױ������������Ļ�Ӧ���ǣ�92g�ļױ����Եõ�137g�Ķ���������137g��������������ô13g�ļױ����ܵõ���һ���������������ǣ�$\frac{13��137}{92}$=19.36g���Դ˼���һ�������IJ�����
��� �⣺��1�����ƻ����Һʱ������������Ũ�����ϡ��һ�����ֱ���ȡ10 mL��30mL��Ũ�����Ũ���ᣬ��Ũ���ᵹ���ձ��У�Ũ���������ձ��ڱڻ���ע�룬�����Ͻ��裬���ƻ����Һ�������ᣩ��40mL��
�ʴ�Ϊ����30mLŨ����ע���ձ��У������ձ��ڱ�ע��10mLŨ���ᣬ�ӱ߽��裻
��2���Ʊ�һ�����ױ���Ũ�������������÷�ӦΪ���淴Ӧ��Ũ������ˮ����ƽ��������һ�����ױ������ƶ�����Ũ���������Ϊ��������ˮ����
�ʴ�Ϊ����������ˮ����
��3������A�Ƿ�Һ©����ʹ��ǰ�������Ƿ�©Һ��
�ʴ�Ϊ ��©��
��4����Ϊ��������һ����������ֻ���������Ƿе�IJ�ͬ����˲�������ķ�����ʹ�õ����ṩ�����еķֱ��ǣ�������ƿ���ƾ��ơ��¶ȼơ������ܡ���ƿ��β�ӹܣ�
�ʴ�Ϊ��6��
��5�����ʵļ��㷽��������ʵ�ʲ����������۲�������駷���ʽ��һĦ���ļױ����Եõ�һĦ���Ķ������ױ���һĦ�����������ױ������������Ļ�Ӧ���ǣ�92g�ļױ����Եõ�137g�Ķ���������137g��������������ô13g�ļױ����ܵõ���һ���������������ǣ�$\frac{13��137}{92}$=19.36g��һ�������IJ���Ϊ$\frac{17.42}{19.36}$��100%=89.99%��
�ʴ�Ϊ��89.99%��
���� ������Ҫ����һ�����ױ����Ʊ����漰ʵ�����̡����ʵļ����֪ʶ���ѶȲ�����Ϥ���̵�������Ŀ���ǽ���Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɫ������Һ�У�Na+��SO42-��MnO4-��NO3- | |
| B�� | ʹ��ɫ��̪��Һ�ʺ�ɫ����Һ�У�Na+��Cu2+��SO42-��Cl- | |
| C�� | pH=1����Һ�У�K+��ClO-��S2-��Cl- | |
| D�� | �����Ե���Һ�У�Na+��K+��HCO3-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ����� | ������Һ �����mL�� | ������� | |
| �ζ�ǰ�Ŀ̶� ��mL�� | �ζ���Ŀ̶� ��mL�� | ||
| ��һ�� | 10.00 | 0.40 | 20.50 |
| �ڶ��� | 10.00 | 4.10 | 24.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
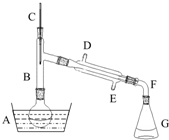 ��������һ����Ҫ���л�����ԭ�ϣ��Ʊ��������ԭ����95%�Ҵ���80%���ᣨ������ˮϡ��Ũ���ᣩ����ϸ���廯�Ʒ�ĩ�ͼ������Ƭ���÷�Ӧ��ԭ�����£�NaBr+H2SO4=NaHSO4+HBr
��������һ����Ҫ���л�����ԭ�ϣ��Ʊ��������ԭ����95%�Ҵ���80%���ᣨ������ˮϡ��Ũ���ᣩ����ϸ���廯�Ʒ�ĩ�ͼ������Ƭ���÷�Ӧ��ԭ�����£�NaBr+H2SO4=NaHSO4+HBr| ���� ���� | �Ҵ� | ������ | 1��2-�������� | ���� | Ũ���� |
| �ܶ�/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| �۵㣨�棩 | -130 | -119 | 9 | -116 | 10 |
| �е㣨�棩 | 78.5 | 38.4 | 132 | 34.6 | 338 |
| ��ˮ�е��ܽ�ȣ�g�� | ���� | 0.914 | 1 | 7.5 | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
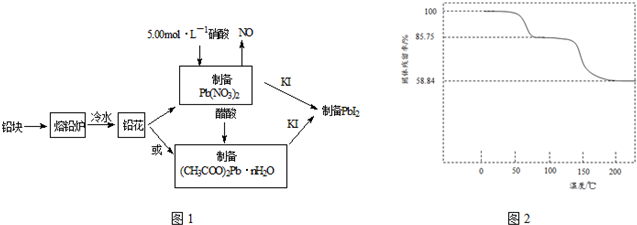
| ʵ������ | ʵ�鷽�� | ʵ������ԭ����� |
| �ٻ�����Ũ�������ƽ���Ӱ�� | ȡPbI2������Һ������һ֧�Թ��У��ٵ��뼸��NaI������Һ | ������Һ��c��I-������ʹQ������PbI2��Ksp |
| ��Ǧ����Ũ�ȼ�С��ƽ���Ӱ�� | ȡPbI2����Һ������һ֧�Թ��У��ټ�������NaCl������Һ | ����ɫ������ʧ ԭ���γ�PbCl42-��������Һ��c��Pb2+����С��ʹQcС��PbI2��Ksp |
| ��Ǧ���Ӻ͵�����Ũ�ȶ���С��ƽ���Ӱ�� | ��PbI2����Һ�е��뼸��FeCl3 ������Һ | ����ɫ������ʧ д����Ӧ�����ӷ���ʽ�� PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

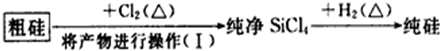
| ���� | Si | SiCl4 |
| �е�/�� | 2355 | 57.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
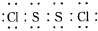 �������ȶ�����ˮ������᪻���Ӧ��һ������Ԫ�ؼ�̬���ߣ�һ���ֽ��ͣ�����Ӧ�漰�ļ������ʵ��۷е������
�������ȶ�����ˮ������᪻���Ӧ��һ������Ԫ�ؼ�̬���ߣ�һ���ֽ��ͣ�����Ӧ�漰�ļ������ʵ��۷е������| ���� | S | CS2 | CCl4 | S2Cl2 |
| �е�/�� | 445 | 47 | 77 | 137 |
| �۵�/�� | 113 | -109 | -23 | -77 |
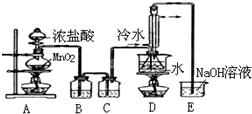
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
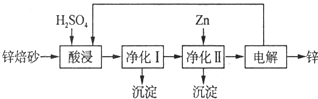
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
| CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | ||
| �� | 390 | 0.20 | 0.080 | 0.080 |
| �� | 390 | |||
| �� | 230 | 0.20 | 0.090 | 0.090 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com