
分析 根据澄清溶液得,原溶液没有相互反应的离子,
(1)根据实验(1)溶液呈酸性判断氢离子一定存在,与氢离子反应的离子不能够共存;
(2)根据实验(2)加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色,说明溶液中一定含有碘离子,能够与碘离子反应的离子不共存;
(3)根据实验(3)加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产判断凡是与氢氧根离子反应生成沉淀的离子不存在;
(4)根据实验(4)另取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成,可知一定含有碳酸根离子,排除与该离子反应的离子;
(5)用焰色反应检验含有的金属阳离子.
解答 解:(1)根据实验(1)现象:溶液呈强酸性,说明溶液中肯定含有H+,而H+与CO32-反应发生反应而不能共存,说明溶液中肯定不含有CO32-,
故答案为:CO32-;
(2)根据实验(2)现象:CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-,而I-与NO3-和H+能发生氧化还原反应,而不能共存,说明溶液中肯定不含有NO3-,
故答案为:NO3-
(3)根据实验(3)现象:溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Mg2+、Al3+能与碱反应产生沉淀,说明溶液中肯定不含有Mg2+、Al3+,
故答案为:Mg2+、Al3+;
(4)根据实验(4)现象:取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+,而Ba2+能与SO42-产生沉淀,说明溶液中不含SO42-,
故答案为:Ba2+;SO42-;
(5)由上述实验事实确定,该溶液中肯定存在的离子是:Ba2+、I-、NH4+;
肯定不存在的离子是:Mg2+、Al3+、NO3-、CO32-、SO42-;
还不能确定是否存在的离子是:K+、Na+、Cl-,
故答案为:Ba2+、I-、NH4+;Mg2+、Al3+、NO3-、CO32-、SO42-;K+、Na+、Cl-.
点评 本题考查常见离子的检验方法,为高频考点,题目难度中等,把握常见离子之间的反应、离子检验等为推断的关键,侧重分析与推断能力的综合考查,有利于提高学生的灵活应用能力.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L水中所含原子总数为3NA | |
| B. | 常温常压下,44 gC3H8中含有的碳碳单键数为3NA | |
| C. | 标准状况下,44.8 L NO与22.4L O2混合后,气体分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴.阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化,通常表现为热量的变化 | |
| B. | 反应物的总能量高于生成物的总能量时发生放热反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 | |
| D. | 一氧化碳在氧气中的燃烧是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3的分解率为20% | B. | 10分钟内ν(SO2)=0.01mol/(L•min) | ||
| C. | 容器内气体的密度为40g/L | D. | 此温度下反应①的平衡常数为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
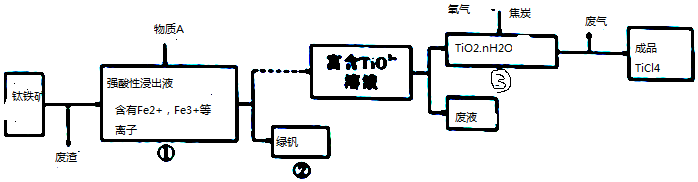
| Mg | MgCl2 | Ti | |
| 熔点/℃ | 648.0 | 714 | 1667 |
| 沸点/℃ | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na与足量O2反应生成Na2O和Na2O2时,失去的电子数为2NA | |
| B. | 在密闭容器中,加入1mol N2和3mol H2,充分反应后生成NH3分子数为2NA | |
| C. | 足量铁在1mol Cl2中充分燃烧,转移的电子数目为2NA | |
| D. | 32gCu与S完全反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
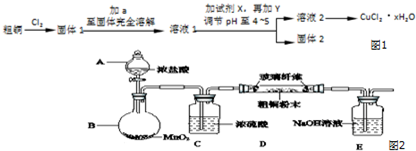
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com