
| A. | 分子晶体中范德华力没有方向性和饱和性,所以分子晶体一般都采取密堆积,但要受到分子形状的影响 | |
| B. | 由于共价键的方向性和饱和性,原子晶体堆积的紧密程度大大降低 | |
| C. | 配位数就是配位键的数目 | |
| D. | 离子晶体一般都是非等径球的密堆积 |
分析 A.范德华力为分子间作用力,没有方向性和饱和性,分子晶体堆积都采取密堆积,受到分子形状的影响;
B.共价键的饱和性与原子的未成对电子数有关,形成共价键时,原子轨道重叠的程度越大越好,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向就存在着必然的联系,这种成键的方向性也就决定了所形成分子的构型;
C.配位数是指由中心原子或离子(统称中心原子)围绕它的分子或离子数;
D.离子晶体的结构类型取决于晶体中阴阳离子的半径比、阴阳离子的电荷比和离子键的纯粹程度.
解答 解:A.分子晶体的堆积受分子间作用力的影响,与分子内的共价键无关,由于范德华力没有方向性和饱和性,所以分子在堆积成晶体时只有范德华力将采取分子密堆积,但要受到分子形状的影响,故A正确;
B.因为共价键有饱和性和方向性,所以原子晶体不能紧密堆积,不遵循“紧密堆积”原理,原子晶体堆积的紧密程度大大降低,故B正确;
C.配位数是指由中心原子周围的分子或离子数,配合物中中心原子提供空轨道,配体提供孤电子对;如在配合物[Co(NH3)5Cl]Cl2中,外界是Cl-,內界是[Co(NH3)5Cl]2+,Co3+为中心离子提供空轨道,Cl、NH3为配体提供孤电子对,有一个氯离子和五个氨分子做配体,配位数为6,不是配位键的数目5,故C错误;
D.离子晶体由阴阳离子构成,结构类型取决于晶体中阴阳离子的半径比、阴阳离子的电荷比和离子键的纯粹程度,阴阳离子的半径不同,一般都是非等径球的密堆积,故D正确;
故选C.
点评 本题主要考查了晶体的堆积方式与原因,为高频考点,侧重考查学生分析及空间想象能力,注意对应知识的掌握,题目难度中等.


科目:高中化学 来源: 题型:选择题
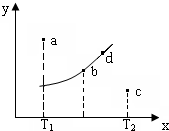 图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )
图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )| A. | Q<0 | |
| B. | 平衡常数值:b点<d点 | |
| C. | T1温度下若由a点达到平衡,可以采取增大压强的方法 | |
| D. | c点v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2中含有的阴离子数等于0.2NA | |
| B. | 0.1 mol 16OD-离子含有的电子、中子数均为1.0NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 燃料电池属于一次电池 | |
| B. | 另一极的电极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在正极发生氧化反应 | |
| D. | 电池总反应为:2CH3CH2OH+O22CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由蛋白质得到氨基酸、由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br-═2Cl-+Br2 Zn+Cu2+═Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O═4NaOH+O2↑ Cl2+H2O═HCl+HClO | 均为水作还原剂的氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
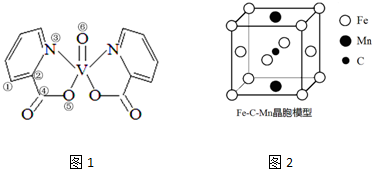
 ,其分子呈直线形.
,其分子呈直线形. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质和弱电解质的本质区别在于:强电解质易溶于水,弱电解质 难溶于水 | |
| B. | 强电解质都是可溶性化合物,弱电解质都是难溶性化合物 | |
| C. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 | |
| D. | 强电解质溶液的导电能力强,弱电解质溶液的导电能力弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
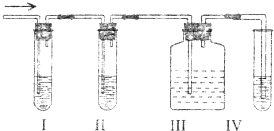 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与溶液的本质区别是丁达尔效应 | |
| B. | 氯化铁溶液可应急止血,利用的是胶体的聚沉 | |
| C. | 用一束平行光线入射淀粉溶液里,从侧面可以观察到一条光亮的通路 | |
| D. | 将稀硫酸逐滴加入氢氧化铁胶体中,开始时产生沉淀,继续滴加时沉淀又溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com