
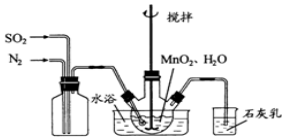
分析 Ⅰ.(1)由题可知,二氧化锰和二氧化硫制得MnSO4;
(2)SO2有毒,污染空气,石灰乳与SO2发生反应,吸收未反应的SO2;
(3)为使SO2尽可能转化完全,可以控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,或者减小SO2在混合气(与N2)中的比例等;
(4)水浴加热的优点是受热均匀,容易控制温度;
Ⅱ.(1)pH=7.7时Mn(OH)2开始沉淀,故应选择将Na2CO3溶液缓慢滴加到MnSO4溶液中,边加边搅拌;
(2)MnCO3固体表面附着硫酸根离子,故检验MnCO3固体是否洗涤干净的方法为检验其洗涤液是否含有硫酸根离子即可;
(3)已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解,乙醇沸点低于100℃,便于低温干燥且MnCO3不分解;
(4)计算MnSO4溶液与20.0mL 2.0mol/L的Na2CO3溶液混合制得碳酸锰的理论量,再计算其产率.
解答 解:Ⅰ.(1)二氧化锰具有氧化性,二氧化硫具有还原性,制取MnSO4的化学反应方程式为:MnO2+SO2=MnSO4;
故答案为:MnO2+SO2=MnSO4;
(2)SO2有毒,污染空气,石灰乳与SO2发生反应,吸收未反应的SO2;
故答案为:吸收尾气SO2,防止污染空气;
(3)为使SO2尽可能转化完全,可以控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,或者减小SO2在混合气(与N2)中的比例等;
故答案为:控制适当的水浴温度、减缓通入气体的速度、减小SO2在混合气(与N2)中的比例;
(4)水浴加热的优点是受热均匀,容易控制温度;
故答案为:受热均匀,容易控制温度;
Ⅱ.(1)pH=7.7时Mn(OH)2开始沉淀,故应选择将Na2CO3溶液缓慢滴加到MnSO4溶液中,边加边搅拌;
故答案为:a;
(2)MnCO3固体表面附着硫酸根离子,故检验MnCO3固体是否洗涤干净的方法为检验其洗涤液是否含有硫酸根离子,方法为:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,如果不产生沉淀,说明已洗涤干净,否则说明未洗涤干净;
故答案为:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,如果不产生沉淀,说明已洗涤干净,否则说明未洗涤干净;
(3)已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解,乙醇沸点低于100℃,便于低温干燥且MnCO3不分解;
故答案为:乙醇沸点低于100℃,便于低温干燥且MnCO3不分解;
(4)MnSO4溶液与20.0mL 2.0mol/L的Na2CO3溶液混合理论得到碳酸锰的物质的量为:20.0mL×10-3×2.0mol/L=0.04mol,质量为:0.04mol×115g/mol=4.6g,则产率为:$\frac{3.45g}{4.6g}×100%$=75%;
故答案为:75%.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、物质含量测定、实验方案设计、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:选择题
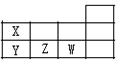
| A. | 原子半径:Y>Z>W | B. | 酸性:HWO4>HXO3>H3YO4 | ||
| C. | 热稳定性:HW>XH3>YH3 | D. | 离子半径:Y3-<Z2-<W- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式 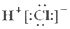 | B. | Cl-的结构示意图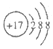 | ||
| C. | CO2的电子式 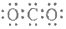 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
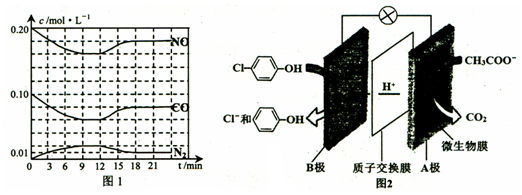
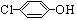 )的酸性废水;可利用微生物电池法除去,其原理如图2所示.
)的酸性废水;可利用微生物电池法除去,其原理如图2所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
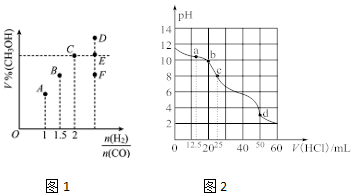
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
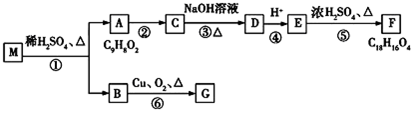
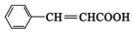 ,E中含有官能团的名称是羟基、羧基.
,E中含有官能团的名称是羟基、羧基. 或
或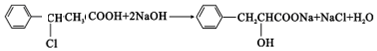 、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.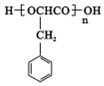 或
或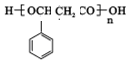 ,由E导H的反应类型为缩聚反应.
,由E导H的反应类型为缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
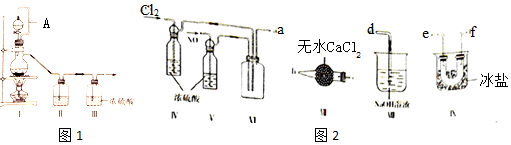
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | ① | ② |
| 制备纯净NO | Cu | ③ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 | |
| B. | 某氧化物焰色反应为黄色,该氧化物为过氧化钠 | |
| C. | Na2O2中阴阳离子个数比1:l | |
| D. | 过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com