
����Ŀ����ͼ�е�ÿһ�������ʾ�йص�һ�ַ�Ӧ������������A��CΪ��ɫ����
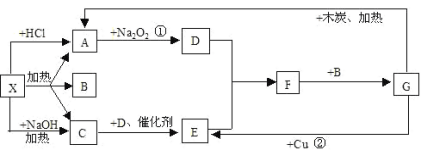
��1��д���й����ʵĻ�ѧʽX��_______��F_______
��2��д��A��D�Ļ�ѧ����ʽ____________����
��3��д��ʵ�����Ʊ�C�Ļ�ѧ����ʽ_______
��4��C�������Ʊ����أ�����CO(NH2)2�����ڸ��������������������ط���ˮ�⣬�����������壬��ˮ��Ļ�ѧ����ʽ��______
��5���ֱ�ȡ����50mLNaOH��Һ����������ͨ��һ����������A������ȡ��Һ10mL�ֱ���ϡ�͵���ͬ������õ���Һ���ң��ֱ����������μ���0.1mol/L��HCl��Һ��������A�����������״���£����������HCl�����֮��Ĺ�ϵ��ͼ��ʾ����
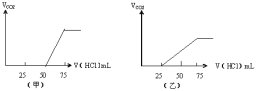
��NaOH������A�������ͼ��ʾ��Һ�д��ڵ������ǣ�_____�������ʵ���֮���ǣ�_________
��ԭNaOH��Һ�����ʵ���Ũ����_______mol/L����ͼ��ʾ��Һ��������A���Ϊ_____mL(��״��)��
���𰸡�NH4HCO3 �� (NH4)2CO3 NO2 2CO2+2Na2O2 =2Na2CO3+O2 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O CO(NH2)2+H2O=2NH3��+CO2�� NaHCO3��Na2CO3 1:1 0.75 112
CaCl2+2NH3��+2H2O CO(NH2)2+H2O=2NH3��+CO2�� NaHCO3��Na2CO3 1:1 0.75 112
��������
X���������ᷴӦ��������NaOH��Ӧ�����������壬ӦΪ������Σ���CΪNH3������A����������Ʒ�Ӧ����AΪCO2����XӦΪ(NH4)2CO3��NH4HCO3��BΪH2O�����ת����ϵ����֪����DΪO2��EΪNO��FΪNO2��GΪHNO3��������ʵ����ʽ��н��
��1���ɷ�����֪��XΪ(NH4)2CO3��NH4HCO3��FΪNO2���ʴ�Ϊ��(NH4)2CO3��NH4HCO3��NO2��
��2���ɷ�����֪��AΪCO2��DΪO2��Na2O2��CO2��Ӧ����O2����Ӧ����ʽΪ��2CO2+2Na2O2 =2Na2CO3+O2���ʴ�Ϊ��2CO2+2Na2O2 =2Na2CO3+O2��
��3��ʵ�����Ʊ������������Ȼ�������������ڼ��������·�Ӧ����Ӧ����ʽΪ��2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O���ʴ�Ϊ��2NH4Cl+Ca(OH)2
CaCl2+2NH3��+2H2O���ʴ�Ϊ��2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
��4�����ص�ˮ�������������壬������ص�Ԫ����ɣ������ɵ��ǰ����Ͷ�����̼���ʷ�ӦΪ��CO(NH2)2+H2O=2NH3��+CO2�����ʴ�Ϊ��CO(NH2)2+H2O=2NH3��+CO2����
��5��������CO2����ʱ��������ӦNaHCO3+HCl=NaCl+H2O+CO2����
�ټ��������̼��NaOH��Ӧ����Һ��ֻ��Na2CO3����ʼ������ӦNa2CO3+HCl=NaHCO3+NaCl����������Ӧ��NaHCO3+HCl=CO2��+NaCl+H2O��ǰ��������������������ȣ���ʵ��ǰ��������������������ֱ�Ϊ25mL��50mL��ǰ�������������С�ں�Σ���������NaHCO3��Na2CO3���ɷ�ӦNa2CO3+HCl=NaHCO3+NaCl������֪��n(Na2CO3)=n(HCl)=0.025L��0.1mol/L=0.0025mol�����ɵ�̼������Ϊ0.0025mol���ɷ�ӦNaHCO3+HCl=CO2��+NaCl+H2O������֪���ܵ�̼������Ϊ0.05L��0.1mol/L=0.05mol����ԭ��Һ��̼������Ϊ0.05mol-0.0025mol=0.0025mol�������ʵ���֮����1:1���ʴ�Ϊ��NaHCO3��Na2CO3��1:1��
�ڼ���75mL����ʱ����Һ�����ʶ�ǡ����ȫ��Ӧ����ʱ��ҺΪNaCl��Һ������Na��Cl�غ��֪10mL��Һ��n��NaOH��=n��NaCl��=n��HCl��=0.075L��0.1mol/L=0.0075mol����ԭ����������Һ��Ũ��=![]() =0.75mol/L�����ף�������CO2�������������HClΪ25mL����������̼��NaOH��Ӧ����Һ�в���NaHCO3����Na2CO3+HCl=NaHCO3+NaCl��֪����CO32-ת��ΪHCO3-Ӧ����HClΪ25mL����ͼ���п�ʼ����CO2����ʱ����HCl���Ϊ50mL��˵���ýλ�������ӦNaOH+HCl=NaCl+H2O����Һ������ΪNaOH��Na2COspan>3���к�NaOH����HCl�����Ϊ50mL-25mL=25mL��n(Na2CO3)=n(HCl)=0.025L��0.1mol/L=0.0025mol��n(NaOH)=n(HCl)=0.025L��0.1mol/L=0.0025mol�����ݷ�Ӧ����ʽ��Na2CO3+H2O+CO2=2NaHCO3��NaOH+CO2=NaHCO3����Һ��������CO2�����ʵ���Ϊ0.0025mol+0.0025mol=0.005mol���ڱ�״�������Ϊ0.005mol��22.4L/mol=112mL���ʴ�Ϊ��0.75mol/L��112��
=0.75mol/L�����ף�������CO2�������������HClΪ25mL����������̼��NaOH��Ӧ����Һ�в���NaHCO3����Na2CO3+HCl=NaHCO3+NaCl��֪����CO32-ת��ΪHCO3-Ӧ����HClΪ25mL����ͼ���п�ʼ����CO2����ʱ����HCl���Ϊ50mL��˵���ýλ�������ӦNaOH+HCl=NaCl+H2O����Һ������ΪNaOH��Na2COspan>3���к�NaOH����HCl�����Ϊ50mL-25mL=25mL��n(Na2CO3)=n(HCl)=0.025L��0.1mol/L=0.0025mol��n(NaOH)=n(HCl)=0.025L��0.1mol/L=0.0025mol�����ݷ�Ӧ����ʽ��Na2CO3+H2O+CO2=2NaHCO3��NaOH+CO2=NaHCO3����Һ��������CO2�����ʵ���Ϊ0.0025mol+0.0025mol=0.005mol���ڱ�״�������Ϊ0.005mol��22.4L/mol=112mL���ʴ�Ϊ��0.75mol/L��112��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
A.0.01molNH4+����������Ϊ0.1NA
B.4.48 L N2��CO�Ļ��������������Ϊ0.2NA
C.6.2 g��������Ļ������������ԭ����Ϊ0.2NA
D.10.0mL 12 mol��L-1Ũ�����������������̷�Ӧ��ת�Ƶ�����Ϊ0.06NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں�Fe3+��S2O82����I���Ļ����Һ�У���ӦS2O82��(aq)+2I��(aq)=2SO42��(aq)+I2(aq)�ķֽ��������Ӧ�����е������仯���£�
�������2Fe3+(aq)+2I��(aq)=I2(aq)+2Fe2+(aq)
�������2Fe2+(aq)+S2O82��(aq)=2Fe3+(aq)+2SO42��(aq)
�����йظ÷�Ӧ��˵����ȷ����

A. ��ѧ��Ӧ������Fe3+Ũ�ȵĴ�С�й�
B. �÷�ӦΪ���ȷ�Ӧ
C. Fe2+�Ǹ÷�Ӧ�Ĵ���
D. ������Fe3+��������Ӧ�Ļ�ܱ��淴Ӧ�Ĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(һ)д�����з�Ӧ�Ļ�ѧ����ʽ��
(1)ʵ��������ϩ__________________________________
(2)�üױ��Ʊ�TNT________________________________
(3)���Ӻ�Ũ��ˮ�ķ�Ӧ_____________________________
(4)1��2-�����������������������Ƶ��Ҵ���Һ���ȣ�____________________________
(5)��ȩ��������Һ�ķ�Ӧ____________________________
(��)(1)����ϵͳ��������![]() ��������_________________
��������_________________![]() ��������_________________________________________________��
��������_________________________________________________��
(2) ˳-2-��ϩ�Ľṹ��ʽ��________________
(3)��֪��������H2YO3�ĵ���ƽ�ⳣ��Ka1=1.4��10��2��Ka2=6.3��10��8��NaHYO3��Һ������Ũ�ȴӴ�С��˳����_________________________________
(4) ijͬѧȡ��10 mL 0.010 mol��L��1��ˮ����pH��ֽ����pH��a��Ȼ��������ˮϡ����1 000 mL������pH��ֽ����pH��b����Ҫȷ��NH3��H2O��������ʣ���a��bֵӦ����Ĺ�ϵ��________��
(5)25 ��ʱ����a mol��L��1��ˮ��0.01 mol��L��1����������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)��c(Cl��)���ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ϵʽ����˵����ӦN2��3H2![]() 2NH3�Ѵﵽƽ��״̬����(����)
2NH3�Ѵﵽƽ��״̬����(����)
A. 3v��(N2)��v��(H2) B. v��(N2)��v��(NH3)
C. 2v��(H2)��3v��(NH3) D. v��(N2)��3v��(H2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ѧ��Ӧ��ƽ�ⳣ������ʽΪK��![]() ���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ�������й���������ȷ����( )
���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ�������й���������ȷ����( )
t/�� | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A. �÷�Ӧ�Ļ�ѧ����ʽ��CO(g)��H2O(g)![]() CO2(g)��H2(g)
CO2(g)��H2(g)
B. ������Ӧ������Ӧ�Ƿ��ȷ�Ӧ
C. ����1 L���ܱ�������ͨ��CO2��H2��1 mol,5 min���¶����ߵ�830 �棬��ʱ���COΪ0.4 mol����÷�Ӧ�ﵽƽ��״̬
D. ��ƽ��Ũ�ȷ������й�ϵʽ��![]() ��
��![]() �����ʱ���¶�Ϊ1 000 ��
�����ʱ���¶�Ϊ1 000 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ʵ����Ҫ����500 mL 0.2 mol/L NaOH��Һ����ش��������⣺
��1�����ƹ����в���Ҫʹ�õĻ�ѧ������________������ĸ����
A �ձ� B 500 mL����ƿ C ©�� D ��ͷ�ι� E ������
��2����������ƽ��ȡ�������ƣ�������Ϊ________ g��
��3��������Ҫ�����������ȷ˳����________������ţ���
�ٳ�ȡһ���������������ƣ������ձ��У�����������ˮ�ܽ⣻
�ڼ�ˮ��Һ��������ƿƿ���̶�����1��2 cmʱ�����ý�ͷ�ιܵμ�����ˮ����Һ����̶������У�
�۴���ȴ�����º���Һת�Ƶ�500 mL����ƿ�У�
�ܸǺ�ƿ�����������µߵ���ҡ�ȣ�
������������ˮϴ���ձ��ڱںͲ�����2��3�Σ�ϴ��Һת�Ƶ�����ƿ�С�
��4�����ʵ�������ȱ�ٲ���ݣ���ʹ���Ƴ���NaOH��ҺŨ��_______������ƫ�ߡ�ƫ������������������
��.��ͼʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺

��1����Ũ������HCl�����ʵ���Ũ��Ϊ______ mol/L��
��2��ȡ����������ĸ�������Һʱ�������������в�����ȡ����Ķ��ٶ��仯����______��
A ��Һ��HCl�����ʵ������� B ��Һ��Ũ��
C ��Һ��Cl������Ŀ D ��Һ���ܶ�
��3��ijѧ����������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.400 mol/L��ϡ���ᡣ��ѧ����Ҫ��ȡ______mL����Ũ����������ơ�
��.����0.27Kg��������Ϊ10����CuCl2��Һ,����Һ��CuCl2�����ʵ���Ϊ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
����ε���Ҫ����Ϊ�������Ρ������(KIO3)�������軯��[K4Fe(CN)6��3H2O]�����������軯�ص���ˮ���ڸ����»ᷢ���ֽ⣺3K4[Fe(CN)6]![]() 2(CN)2��+12KCN+N2��+Fe3C+C
2(CN)2��+12KCN+N2��+Fe3C+C
��ش��������⣺
��1����Fe2+��̬��������Ų�ʽΪ_____��
��![]() �Ŀռ乹��Ϊ______����������������
�Ŀռ乹��Ϊ______����������������
�ۣ�CN��2������̼ԭ���ӻ��������Ϊ_______��һ����CN-��Ϊ�ȵ�����ķ��ӵĵ���ʽΪ_______��
��1molFe(CN)63�к�����������ĿΪ____mol��
��2�������Fe(CO)x������ԭ�Ӽ۵������������ṩ������֮��Ϊ18����x��___��Fe(CO)x�����³�Һ̬���۵�Ϊ��20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ˿��ж�Fe(CO)x��������____(�������)��
��3����ͼ�Ǵ����������Ӿ���Fe3O4��ȡ�����������侧��ṹ��һ�������壬����������Dz���Fe3O4�ľ���______(����������������)�������������������Ӵ���������Χ�ɵ�________(��ռ�ṹ)��϶��

��4��Fe���γɶ������������FeO�����ṹΪNaCl�͡�������ʵ���ϴ��ڿ�λ����λ������ԭ�ӵ�ȱ�ݣ�����ȱ�ݶԾ�������ʻ�����ش�Ӱ�졣���ھ���ȱ�ݣ��ھ�����Fe��O�ĸ����ȷ����˱仯����ΪFexO��x��1���������ijFexO�����ܶ�Ϊ5.71gcm��3�������߳�Ϊ4.28��10��10 m����FexO��x=____�����ô���ʽ��ʾ����Ҫ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݣ��ݴˣ�����˵����ȷ���ǣ� ��

A. ����������ʵ���Ũ��Ϊ9.2 molL-1
B. ����200 mL 4.6 molL-1��ϡ������ȡ������25 mL
C. ��������������ˮ��Ϻ�������ҺŨ��Ϊ9.2 molL-1
D. ������������ˮ��Ϻ�������������49%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com