
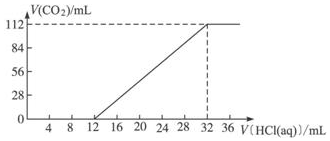
 ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.
ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.分析 RHCO3和R2CO3,与稀盐酸反应的化学方程式分别是RHCO3+HCl═RCl+H2O+CO2↑、R2CO3+HCl═RHCO3+RCl,再根据提供的数据可以进行相关方面的计算;(1)根据碳元素守恒及生成二氧化碳的量计算出混合物中含碳量;
(2)计算出混合物的平均摩尔质量,然后判断碱金属名称,从而可确定两种碳酸盐的化学式;
(3)根据两种碳酸盐的质量、物质的量列式计算出消耗氯化氢的物质的量,再根据c=$\frac{n}{V}$计算出滴加的盐酸的浓度.
解答 解:(1)根据质量守恒可知:n(C)=n(CO2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,所以原混合物中碳元素的物质的量为:0.05mol,故答案为:0.05mol;
(2)混合物的平均摩尔质量M=$\frac{6.14g}{0.005mol×10}$=122.8g/mol,
若M(M2CO3)=122.8 g/mol,则M(M)=31.4g/mol,
若M(MHCO3)=122.8 g/mol,则M(M)=61.8g/mol,
即:31.4g/mol<M(K)<61.8g/mol,
所以碱金属元素是钾元素,故答案为:K;
(3)碳酸盐的总物质的量为:n(K2CO3)+n(KHCO3)=0.05 mol,
质量为:n(K2CO3)×138 g/mol+n(KHCO3)×100 g/mol=6.14 g,
解得:n(K2CO3)=0.03mol、n(KHCO3)=0.02 mol,
则:n(K2CO3)~n(CO2)~2n(HCl) n(KHCO3)~n(CO2)~n(HCl)
0.03 mol 0.03mol 0.06 mol 0.02 mol 0.02 mol 0.02 mol
所以消耗盐酸的总物质的量为:n(HCl)=0.06 mo+0.02mol=0.08 mol,
则所滴加盐酸的物质的量浓度为:c(HCl)=$\frac{0.08mol}{0.32L}$=0.25mol/L,
故答案为:0.25 mol•L-1.
点评 本题考查了混合物反应的计算,题目难度较大,明确发生反应的实质为解答关键,注意掌握守恒法、极值法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 常用热的纯碱溶液清洗餐具上的油污 | |
| B. | “84”消毒液能漂白有色物质 | |
| C. | 常用消石灰改良酸性土壤 | |
| D. | 明矾、硫酸铁常用于净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
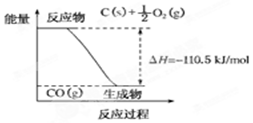
| A. | 12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ | |
| B. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)═2CO(g);△H=-221 kJ | |
| D. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 用标准盐酸滴定未知浓度的烧碱,滴定前仰视,滴定后俯视,烧碱浓度偏低 | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (填写电子式).
(填写电子式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-1/2(4x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO2含有6.02×1023个原子 | |
| B. | 1molNa2CO3的质量为106g | |
| C. | Na+的摩尔质量等于23g/mol | |
| D. | 0.012kg12C中碳原子数约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | |
| A | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| B | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| C | 制备氢氧化铁胶体 | 向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色 |
| D | 证明Mg(OH)2沉淀可转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com