
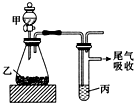
| 甲 | 乙 | 丙 | 结论 | |
| A | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.分别发生复分解反应和加成反应,不能比较稳定性;
B.硫化氢与溴发生氧化还原反应,但不能比较Cl-、Br-的还原性;
C根据氧化剂氧化性大于氧化产物的氧化性比较;
D.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与苯酚钠溶液反应.
解答 解:A.分别发生复分解反应和加成反应,不能比较稳定性,故A错误;
B.硫化氢与溴发生氧化还原反应,没有涉及Cl-、Br-的还原性比较,不能比较Cl-、Br-的还原性,故B错误;
C.高锰酸钾氧化浓盐酸生成氯气,氯气置换出溴,可说明氧化性高锰酸钾>Cl2>Br2,故C正确;
D.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与苯酚钠溶液反应,则该实验不能比较H2CO3、苯酚的酸性,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 950 mL,76 g | B. | 500 mL,80 g | C. | 1000 mL,80 g | D. | 1000 mL,76 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
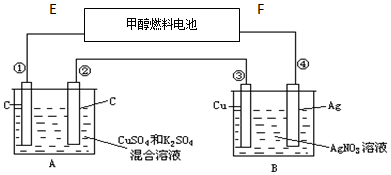
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
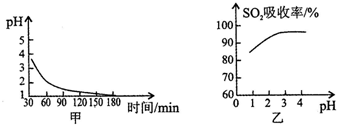 2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.
2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.| 温度/ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O=H2CO3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO | ||
| C. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
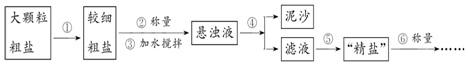

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com