
| 2.5×10-9 |


科目:高中化学 来源: 题型:
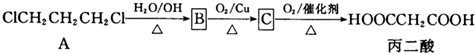
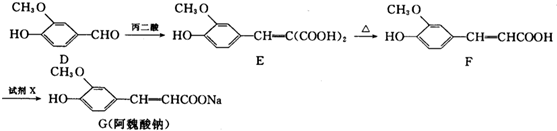
| 丙二酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 陈述Ⅲ |
| A | 加压有利于提高SO2的转化率 | 工业生产硫酸常在高温下进行 | Ⅰ对,Ⅱ对;有 |
| B | Cl2和SO2混合后可用来漂白纸浆 | Cl2和SO2都有较好的漂白作用 | Ⅰ对,Ⅱ错;无 |
| C | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | Ⅰ对,Ⅱ对;有 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对,Ⅱ对;有 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温、高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
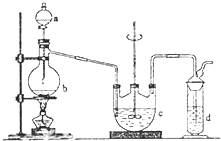 在实验室中可通过如下反应制取硫代硫酸钠Na2S2O3:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
在实验室中可通过如下反应制取硫代硫酸钠Na2S2O3:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com