
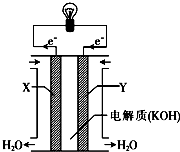
 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:分析 (1)原电池中正负极电极方程式相加即可得到总反应;
(2)根据负极反应为2H2-4e-+4OH-=2H2O,则通入氢气的一极为负极,发生氧化反应,并可判断溶液呈碱性,碱性溶液中正极发生还原反应,电极反应为O2-4e-+2H2O=4OH-,据此分析;
(3)根据电池反应式知,锌失电子发生氧化反应而作负极,氧气在正极得电子发生还原反应,根据电极反应式计算.
解答 解:(1)已知甲烷燃料电池的半反应式分别为:CH4+10OH--8e-═CO32-+7H2O,2O2+4H2O+8e-═8OH-,原电池中正负极电极方程式相加即可得到总反应,则总反应式:CH4+2OH-+2O2═CO32-+3H2O,故答案为:CH4+2OH-+2O2═CO32-+3H2O;
(2)X极的电极反应式为2H2-4e-+4OH-=2H2O,则通入氢气的X极为负极,发生氧化反应,并可判断溶液呈碱性,碱性溶液中正极Y极发生还原反应,电极反应为O2-4e-+2H2O=4OH-;氢氧燃料电池的实质是在一定条件下形成了原电池,其实质仍然是O2把H2氧化,电池总反应为2H2+O2=2H2O,生成了水将碱性溶液稀释,所以电解质溶液的碱性减弱;故答案为:负;O2+2H2O+4e-═4OH-;减弱;
(3)根据电池反应式知,锌失电子发生氧化反应,所以锌作负极,电极反应式为:2Zn-4e-═2Zn2+,氧气在正极得电子发生还原反应,电极反应式为:O2+4H++4e-═2H2O,若电池工作过程中有5.6L O2(标准状况下)即$\frac{5.6L}{22.4L/mol}$=0.25mol参于反应,则转移电子的物质的量为0.25mol×4=1mol;
故答案为:2Zn-4e-═2Zn2+;O2+4H++4e-═2H2O;1mol.
点评 本题考查原电池以及氢氧燃料电池的工作原理,注意电解质溶液的酸碱性不同,则电极反应不同,根据得失电子判断正负极,难点是电极反应式的书写,难度不大.


科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{c(O{H^-})}}{{c(N{H_3}•{H_2}O)}}$ | B. | $\frac{{c(N{H_3}•{H_2}O)}}{{c(O{H^-})}}$ | ||
| C. | c(H+)和c(OH--)的乘积 | D. | OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙的元素符号:Ca | B. | NaCl的形成: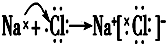 | ||
| C. | 二氧化碳的结构式:O=C=O | D. | S2-的结构示意图: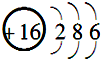 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p3 | B. | ls22s22p63s23p1 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3的电子式: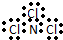 | B. | H- 的结构示意图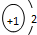 | ||
| C. | 含有4个中子的锂原子:74Li | D. | 次氯酸的结构式:H-Cl-O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com