
| A、4 | B、5 | C、7 | D、8 |
| m |
| M |
| 0.112L |
| 22.4L/mol |
| 1.74g |
| 58g/mol |
| 0.36g |
| 18g/mol |


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
| A、粒子半径:Al3+>Mg2+>Na+>F- |
| B、稳定性:HF>HCl>HBr>HI |
| C、酸性:H4SiO4<H3PO4<H2SO4<HClO4 |
| D、碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | |
| 溶液 | NH3?H2O | NaOH | CH3COOH | NH4HSO4 |
| 物质的量浓度 | c1 | c2 | c3 | c4 |
| A、①、②两种溶液,如果pH相等,则由水电离出的c(OH-)相等 |
| B、如果②、③两溶液混合后,溶液呈中性,则可能c2>c3 |
| C、如果②、④两溶液混合后,溶液呈中性,则溶液中离子浓度顺序为:c(Na+)>c(NH4+)>c(SO42-)>c(H+) |
| D、如果①、③恰好完全反应,所得溶液中有:c(H+)+c(CH3COOH)=c(NH3?H2O)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 足量K2CrO4溶液 |
| 过滤 |
| 过量HI |
| 稀HCl |
| Na2S2O3标液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
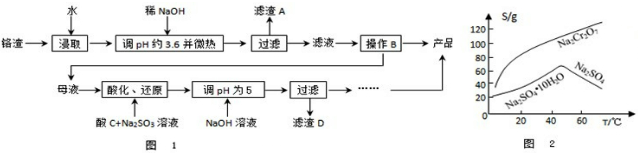
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃煤中加入CaO后可减少酸雨的发生及温室气体的排放量 |
| B、纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
| C、漂白粉、生石灰、明矾均可用于灾后环境的消毒 |
| D、自然条件下,面粉夏季发酵与冬季发酵的速率相差较大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com