
【题目】下列图示与对应叙述相符的是
A.如图:常温下,0.1 mol ·L-1盐酸稀释时pH随加入水的体积变化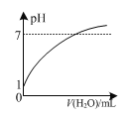
B.如图:铅蓄电池放电时,正极附近溶液的pH随时间的变化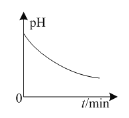
C.如图:不同压强下,可逆反应A(g)+B(g)![]() C(g)+D(s)中A的浓度随时间的变化
C(g)+D(s)中A的浓度随时间的变化
D.如图:镁条放入足量2 mol ·L-1盐酸中,生成氢气速率随时间的变化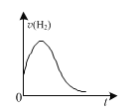
科目:高中化学 来源: 题型:
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL 0.1 mol/L NaOH溶液中加入0.2 mol/L HN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如下图。下列说法正确的是( )
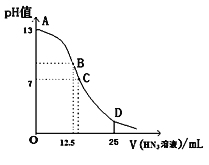
A. 该滴定过程中应用甲基橙作指示剂
B. 若B点pH=8,则c(HN3)=(10-6~10-8 )mol/L
C. 点D对应溶液中存在关系:c(HN3)>c(Na+)>c(N3-)
D. 沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用乙醇和浓硫酸在170℃时制乙烯,化学反应原理为CH3CH2OH![]() CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):
CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):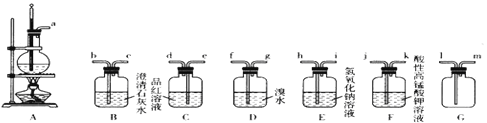
请回答下列问题:
(1)验证乙醇与浓硫酸混合反应产生了二氧化硫和二氧化碳。
①选择必要装置并进行连接:a→__________________(填接口序号)。
②确定混合气体中有二氧化碳存在的实验依据_________________________________。
(2)选择装置制备1,2—二溴乙烷。
①该同学设计的方案中装置连接顺序为A→E→D。此方案是否合理?_________(填“合理”或“不合理”);若不合理,请提出改进方案或方法____________________。
②分离出1,2—二溴乙烷的操作中使用的玻璃仪器为________________________。
③有同学建议在A、E之间增加G装置,其作用是_______,a与G装置接口_______(填“1”或“m”)连接。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 容器中有2HI(g)![]() H2(g)+I2(g),增大压强颜色变深
H2(g)+I2(g),增大压强颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(Fe3+)=0.1 mol·L-1的溶液中:Na+、Cu2+、Cl-、SCN-
B.使甲基橙变红色的溶液中:K+、Fe2+、Cl-、MnO![]()
C.能与Al反应放出大量H2的溶液中:NH![]() 、Na+、Cl-、HCO
、Na+、Cl-、HCO![]()
D.![]() =10-12的溶液中:Mg2+、Al3+、NO
=10-12的溶液中:Mg2+、Al3+、NO![]() 、SO
、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯用“质子![]() ”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知下图:
”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知下图:
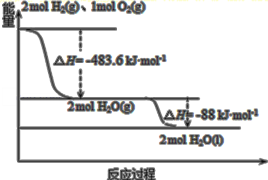
下列说法正确的是
A.2mol![]() 与1mol
与1mol![]() 所具有的总能量比
所具有的总能量比![]() 所具有的总能量低
所具有的总能量低
B.氢气的标准燃烧热为H=-285.8kJ/mol
C.火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g) H=-483.6kJ/mol
D.![]() 变成
变成![]() 的过程中,断键吸收的能量小于成键放出的能量
的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
I.实验探究
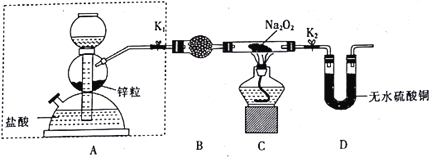
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:________。
(2)B装置中所盛放的试剂是_____,其作用是_______。
(3)步骤3中的必要操作为打开K1、K2,_______(请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为__________。
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:
![]()
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和____。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_____(填“偏大”“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态铜原子的电子排布式为_____;价电子中成对电子数有_____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3 分子中的中心原子的杂化方式是_____。
②P 与 N 同主族,其最高价氧化物对应水化物的酸性:HNO3_____H3PO4(填“>”或“<”),
(3)某磷青铜晶胞结构如下图所示。

①则其化学式为_____。
②该晶体中距离 Cu 原子最近的 Sn 原子有_____个,这些 Sn 原子所呈现的构型为_____。
③若晶体密度为 8.82 g/cm3,最近的 Cu 原子核间距为_____pm(用含 NA 的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com