
【题目】磷化硼(BP)是一种受到高度关注的金属保护层耐磨材料,可由三溴化硼和三溴化磷在氢气中高温制得。
(1)合成BP的反应中,基态原子未成对电子最多的元素符号为____,核外电子数最多的元素的基态原子电子占据最高能级上的电子数为____。B所在的周期第一电离能最大的元素名称为____。
(2)三溴化磷分子的中心原子价层电子对数为____,分子空间结构为____形。BBr3空间结构为____形,PBr3分子中键角比BBr3分子中键角____(填>、<或=)。
(3)N与P同主族。科学家在一定条件下把氮气(氮氮三键键能为942kJmol-1)聚合为固体高聚氮,全部以N-N键相连且键能为160kJmol-1,这种固体高聚氮可能潜在的用途是____,这是因为____。
(4)BP晶胞,磷原子在晶胞中采用金属铜原子的堆积方式,硼原子填充在其四面体空隙中,则其四面体填充率为____,已知晶胞参数a=478pm,则硼和磷原子的核间距为____pm(保留整数)。
【答案】P 5 氖 4 三角锥 平面三角形 < 炸药(或高能材料) 固体高聚氮断开2molN-N键,结合成氮分子,且断裂2molN-N键消耗320kJ,生成1mol氮氮三键放出942kJ,因此这是个剧烈放热且剧烈熵增(产生大量气体)的反应。 50% 207
【解析】
(1)根据B、P、Br的核外电子排布式,判断出基态原子未成对电子最多的元素、核外电子数最多的元素的基态原子电子占据最高能级上的电子数;
(2)结合ABn型分子的中心原子的价层电子对数=![]() 键数+孤电子对数,结合中心原子上的孤电子对数,判断出ABn型分子的中心原子的杂化类型,以及分子空间构型;
键数+孤电子对数,结合中心原子上的孤电子对数,判断出ABn型分子的中心原子的杂化类型,以及分子空间构型;
(3)结合旧键断裂吸收能量,新键形成释放能量,依据题中给的数据进行相关计算;
(4)金属铜为面心立方堆积,面心立方晶胞中存在8个四面体空隙,结合BP的化学式,计算出B原子填隙率;根据硼和磷原子的核间距为晶胞体对角线的![]() ,结合晶胞参数,计算出体对角线。
,结合晶胞参数,计算出体对角线。
(1)基态B原子核外电子排布式1s22s22p1,基态P原子核外电子排布式为1s22s22p63s23p3,基态溴原子的核外电子排布式为[Ar]3d104s24p5,根据洪特规则,基态原子未成对电子最多的元素符号为P,核外电子数最多的元素是Br,占据最高能级上的电子数为5;B在元素周期表中位于第二周期,第二周期第一电离能最大的元素是Ne,其核外电子排布为全充满结构;
(2)三溴化磷分子的中心原子价层电子对数=![]() 键数+孤电子对数,1个PBr3分子中含有3个
键数+孤电子对数,1个PBr3分子中含有3个![]() 键,中心P原子上的孤电子对数为1,故三溴化磷分子的中心原子价层电子对数为4,PBr3分子空间结构为三角锥形;BBr3分子的中心原子价层电子对数3,并且中心原子上不含孤电子对,故BBr3空间结构为平面三角形,PBr3分子中P原子的杂化方式为sp3杂化,BBr3分子中的B的杂化方式为sp2杂化,故PBr3分子中键角比BBr3分子中键角小;
键,中心P原子上的孤电子对数为1,故三溴化磷分子的中心原子价层电子对数为4,PBr3分子空间结构为三角锥形;BBr3分子的中心原子价层电子对数3,并且中心原子上不含孤电子对,故BBr3空间结构为平面三角形,PBr3分子中P原子的杂化方式为sp3杂化,BBr3分子中的B的杂化方式为sp2杂化,故PBr3分子中键角比BBr3分子中键角小;
(3)结合题中的数据信息,固体高聚氮断开2molN-N键,结合成氮分子,且断裂2molN-N键消耗320kJ,生成1mol氮氮三键放出942kJ,因此这是个剧烈放热且剧烈熵增(产生大量气体)的反应,故固体高聚氮可以用作炸药(或高能材料);
(4)金属铜为面心立方堆积,面心立方晶胞中存在8个四面体空隙,倘若被B原子全部填充,则不符合磷化硼的化学组成,据化学式BP可知B原子填隙率仅为50%,其晶胞结构如图所示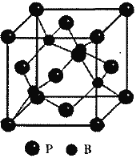 ,已知晶胞参数a=478pm,则晶胞的体对角线长为
,已知晶胞参数a=478pm,则晶胞的体对角线长为![]() ,晶胞中硼和磷原子的核间距为体对角线的
,晶胞中硼和磷原子的核间距为体对角线的![]() ,所以晶胞中硼和磷原子的核间距为
,所以晶胞中硼和磷原子的核间距为![]() 。
。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较金属性的强弱:Na_________K(填“>”、“<”或“=”);反应Na+KClNaCl+K↑能发生的原因是________________。
(2)COCl2是共价化合物,各原子均满足8电子稳定结构。写出COCl2的结构式__________。
(3)电解熔融氧化铝制备金属铝时,需要定期更换阳极石墨块,理由是_________________(用化学反应方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳在冶金工业上具有重要用途。已知氧与碳的反应主要有:
Ⅰ.C(s)+O2(g)CO2(g) △H1=-394kJ·mol-1
Ⅱ.2C(s)+O2(g)2CO(g) △H2=-221kJ·mol-1
Ⅲ.2CO(g)+O2(g)2CO2(g) △H3
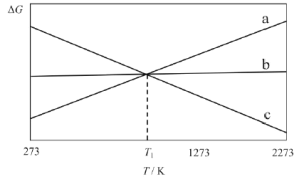
上述反应的△G~T如图所示,且满足△G=△H-T△S。
请回答:
(1)曲线a代表反应_________(填“I”、“II”或“III”),理由是__________。
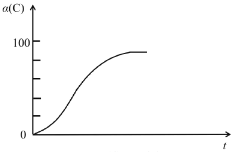
(2)研究发现,以CO2替代高温水蒸气作为煤气化反应(H2O与C反应)的气化剂,实现了CO2零排放的新工艺。写出反应IV的热化学方程式___________(碳的计量数为1)。在1273K时,测得碳转化率[α(C)]与时间t变化如图所示。保持其它条件不变,请画出1773K时α(C)~t关系图______。
(3)当T=T1时,反应IV处于平衡状态,下列关于反应IV的说法正确的是_________。
A.因平衡时△G=0,若△H变化173.3kJ·mol-1,△S变化173.3J·K-1·mol-1,计算得T1=1000K
B.T<T1时,反应向逆反应方向移动
C.当碳的浓度不再变化时,一定处于平衡状态
D.因平衡常数K的值不再变化,反应达到了平衡
(4)当T=1273K时,仅存在CO、CO2两种气体,且维持总压为1 atm,此时反应IV的Kp=112,则CO气体所占的分压p(CO)为___________atm。(列式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法错误的是
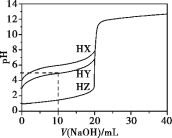
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HX<HY<HZ
B.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
C.根据滴定曲线,可得知Y-的水解常数K约为10-9
D.由图象可知酸碱中和滴定分析不适用于极弱的酸和极弱的碱的测定
查看答案和解析>>
科目:高中化学 来源: 题型:
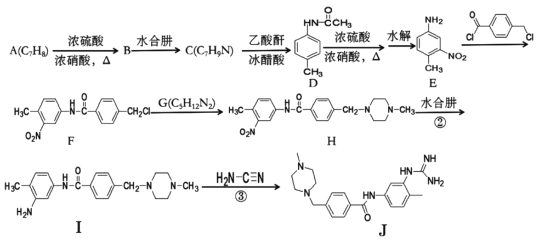
【题目】下面是合成药物格列卫的中间体J的一种合成路线:
回答下列问题:
(1)A的名称为____,B的化学式为____。
(2)F中含氧官能团名称为____
(3)B→C和I→J的反应类型分别为____、____。
(4)G的结构简式为____。
(5)芳香化合物X是D的同分异构体,苯环上具有三个取代基且氨基与苯环直接相连,X能发生银镜反应,分子结构只有一个乙基,符合条件的X的结构式有____种。
(6)写出用甲苯、乙醇为原料制备对氨基苯甲酸乙酯的合成路线:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于如下反应,其反应过程的能量变化示意图如图:
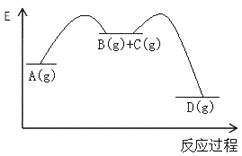
编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g)=B(g)+C(g) | K1 | △H1 |
反应② | B(g)+C(g)=D(g) | K2 | △H2 |
反应③ | A(g)= D(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2B.△H3=△H1+△H2
C.加催化剂,反应①的反应热降低,反应速率加快D.则增大压强,K1减小,K2增大,K3不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常用图所示的装置来制取氨气。请按要求回答下列问题:
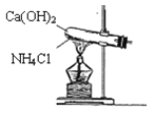
(1)实验室制取氨气的化学反应方程式为__。
(2)除了以上方法。下面也能用于制备氨气的是___。
①固态氯化铵加热分解
②浓氨水中加入固体氢氧化钠
③加热浓氨水
(3)NH3的催化氧化的化学反应方程式为__。
(4)①用装置A收集氨气时,应选择氨气的进气口是___(选填“a”或“b”),并说明选择的理由___。
②打开装置A中的止水夹,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是___、___。
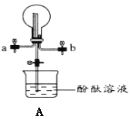
(5)通常可以用什么方法来检验无色溶液中是否有NH4+___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com