
����Ŀ��A��B��C��DΪԭ���������������ǰ������Ԫ�ء�BA3��ʹʪ��ĺ�ɫʯ����ֽ������A��B��C����ԭ�ӵĵ�����֮�͵���25��DC������D+��3d�ܼ��ϵ���ȫ������
��ش��������⣺
��1����������Ԫ���У���һ������������________����Ԫ�ط���)�� D�Ļ�̬ԭ�ӵĺ�������Ų�ʽΪ__________��
��2����BA3��AC�У��е�ϸߵ���________�����ѧʽ)����ԭ����____________��DA�ľ���������____________________��
��3��BA4C�����к��еĻ�ѧ��Ϊ_____________��
a�����»��� b����� c�����Ӽ� d����λ�� e�����ۼ�
��4��������BC3�����幹��Ϊ_____________��������ԭ�ӵ��ӻ��������Ϊ______________��
��5����B��D�γɵľ���ľ���ͼ��ʾ����֪���ڵ�Bԭ����Dԭ�Ӿ���Ϊacm��

�ٸþ�����ѧʽΪ___________��
��BԪ��ԭ�ӵ���λ��Ϊ____________��
�۸þ�����ܶ�Ϊ____________���ú�a��NA�Ĵ���ʽ��ʾ����NAΪ�����ӵ�����ֵ��g��cm-3��
���𰸡� N [Ar]3d104s1 NH3 NH3����֮�������� ���Ӿ��� cde ������ sp3 Cu3N 6 ![]()
��������A��B��C��DΪԭ���������������ǰ������Ԫ�ء�BA3��ʹʪ��ĺ�ɫʯ����ֽ����ӦΪNH3������AΪH��BΪN��A��B��C�ĵ���֮�͵���25����CΪCl��DC������D+��3d�ܼ��ϵ���ȫ������DCl������-1�ۣ���DΪ+1�ۣ�����DΪCu��
(1)����Ԫ�������ɿ�֪��H��N��Cl��Cu��4��Ԫ���У���һ������������N����̬Cuԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s1���ʴ�Ϊ��N��1s22s22p63s23p63d104s1��
(2)��NH3��HCl�У����ڰ�����֮������������Էе�ϸߵ���NH3��CuH�к����������ӣ��������ӻ�����ڹ�̬ʱ�������Ӿ��壬�ʴ�Ϊ��NH3��������֮������������Ӿ��壻
(3)NH4Cl�����к������Ӽ������Լ�����λ������ѡcde��
(4)������NCl3�е�ԭ�ӵļ۲���Ӷ���Ϊ![]() =4����һ�Թµ��Ӷԣ����Է��ӵ����幹��Ϊ�����Σ�����ԭ�ӵ��ӻ�����Ϊsp3�ӻ����ʴ�Ϊ�������Σ�sp3��
=4����һ�Թµ��Ӷԣ����Է��ӵ����幹��Ϊ�����Σ�����ԭ�ӵ��ӻ�����Ϊsp3�ӻ����ʴ�Ϊ�������Σ�sp3��
(5)�ٸ���N��Cu�γɵľ���ľ���ͼ�������к��е�Nԭ�Ӹ���=8��![]() =1��Cuԭ�Ӹ���=12��
=1��Cuԭ�Ӹ���=12��![]() =3���þ�����ѧʽΪCu3N���ʴ�Ϊ��Cu3N��
=3���þ�����ѧʽΪCu3N���ʴ�Ϊ��Cu3N��
�ڸ���N��Cu�γɵľ���ľ���ͼ��ÿ��Nԭ����Χ��6��Cuԭ�ӣ�Nԭ�Ӻ�Cuԭ�ӵľ���Ϊ�����߳���һ�룬�ʴ�Ϊ��6��
��1mol����������Ϊ206g�������߳�Ϊ2acm��1mol���������Ϊ(2a)3NA cm3=8a3NA cm3���þ�����ܶ�Ϊ![]() =
=![]() g��cm-3���ʴ�Ϊ��
g��cm-3���ʴ�Ϊ�� ![]() ��
��


 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���dz��Ը���Ϊԭ�����ǣ�ͬʱ�õ������ĸ��������Ը�������ۺ����ã�����������߾���Ч�棬���һ��ܷ�ֹ������Ⱦ���ְ����·�ʽ���У�

��֪F��H���Ǿ�����ζ��Һ�壬FΪE�����ۺ�������������Ԫ��״�Գƽṹ������գ�
��1��A������________��D��ͬ���칹��Ľṹ��ʽΪ________________��
��2��E��G�Ļ�ѧ����ʽ_________________________��
��3��G��H�Ļ�ѧ����ʽ_________________________��
��4��F�Ľṹ��ʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������ܺͽ����ܵ�ԭ�ϡ�һ�����ú��ܷ��ϣ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��CaO��MgO��̼���л���ȣ���ȡCoC2O4�Ĺ����������£���

��1����550�決�ա���Ŀ����______________________��
��2��������Һ������Ҫ�ɷ���_____________________��
��3�����ܽ�����������Co3+ת��ΪCo2+����Ӧ�����ӷ���ʽΪ_____________________��
��4������������1�������У�����40 ~ 50�����H2O2����������___________________________(�����ӷ���ʽ��ʾ������������80 ~ 85�棬����Na2CO3��Һ����pH��4.5��������1����Ҫ�ɷֵ���
_____________________��
��5������������2���ɽ��ơ�þ����ת��Ϊ�������˳�ȥ����������Һ��c(Ca2+)=1.0��l0-5mol /L������Һ�� c(Mg2+)Ϊ________________ [��֪Ksp(MgF2) =7.35��10-11��Ksp(CaF2) =1.05��10-10]��
��6��Ϊ�ⶨ�Ƶ���Ʒ�Ĵ��ȣ��ֳ�ȡ1.00 g��Ʒ���������ʵ��Լ�ת�����õ������[(NH4)2C2O4]��Һ�����ù���ϡ�����ữ����0. 1000 mol/L KMnO4��Һ�ζ����ﵽ�ζ��յ�ʱ������ȥKMnO4��Һ26.00 mL,���������Ʒ�Ĵ���Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǽ�SO2ת��Ϊ��Ҫ�Ļ���ԭ��H2SO4��ԭ��ʾ��ͼ������˵������ȷ���ǣ� ��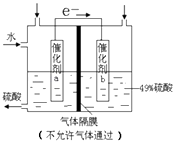
A.��װ�ý���ѧ��ת��Ϊ����
B.����b����O2������ԭ��Ӧ���丽��������ǿ
C.����a����ķ�Ӧ�ǣ�SO2+2H2O��2e��=SO42��+4H+
D.���õ�������Ũ����Ϊ49%���������ϲμӷ�Ӧ��SO2������H2O��������Ϊ8��15
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪C4H9Cl��4��ͬ���칹�壬�����ʽΪC5H10O��ȩ�м���
A.3��B.4��C.5��D.6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫʯ����Һ�м������Na2O2��ĩ������������������ȷ����( )
A. ��Һ����Ϊ��ɫ B. ��Һ���ձ�Ϊ��ɫ
C. ��Һ�������ݲ���������Ϊ��ɫ D. ��Һ�������ݲ���������Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȷ�Ӧ������˵������ȷ���ǣ�������
A. �÷�Ӧ�����ȷ�Ӧ B. ���ȼ��ǻ����
C. �������ø÷�Ӧ�������� D. �÷�Ӧ���ڸ��������½���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�����������л����PԪ����ɵ�����������ȷ����
A. �������֬��ֻ��C��H��O����Ԫ��
B. ø�����е�Ԫ�أ��������ܺ�����Ԫ��
C. ������֯�к��д����ĵ�����
D. ������֬�����ᡢATP�Ȳ���ȱ�ٵijɷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ��������£���1molCH4��1molCl2��Ϻ����ʱ��Ĺ��գ��õ���Һ̬����Ϊ �� ��
A. CH2Cl2��CHCl3��CCl4 B. CCl4
C. CH3Cl��CH2Cl2 ��CHCl3��CCl4 D. CH3Cl
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com