
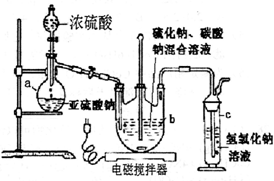
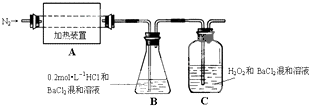
 硫代硫酸钠(Na2S2O3?5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热易分解.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:实验具体操作步骤为:
硫代硫酸钠(Na2S2O3?5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热易分解.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:实验具体操作步骤为:| 实验序号 | 1 | 2 | 3 |
| N2aS2O3溶液体积(mL) | 19.8 | 20.02 | 21.18 |
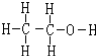 ;
;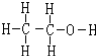 ;
;| 250 | ||
(19.98+20.02)×
|
| ,4.65 |
| 5 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、500mL2mol?L-1稀硫酸 |
| B、150mL5mol?L-1稍酸 |
| C、50mL3mol?L-1盐酸 |
| D、500mL2mol?L-1稀硫酸和少量硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
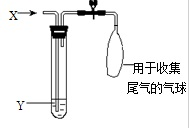 如图是检验气体性质的一种实验装置,请回答:
如图是检验气体性质的一种实验装置,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
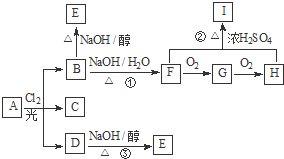 【化学--选修5有机化学基础】
【化学--选修5有机化学基础】查看答案和解析>>
科目:高中化学 来源: 题型:
 硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
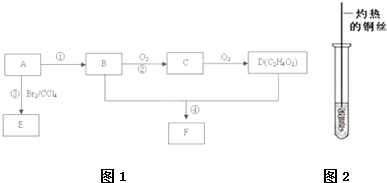
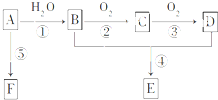 已知A是一种相对分子质量为42的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为42的气态烃,它可转化为其他常见有机物,转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

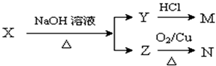
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热,观察是否有气体放出 |
| B、溶于水后加石灰水,看有无沉淀 |
| C、溶于水后加MgCl2溶液,看有无沉淀 |
| D、加热后称量,看质量是否变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com