

分析 由元素在周期表中位置,可知①为H、②为C、③为O、④为Na、⑤为Si、⑥为S、⑦为Cl,
(1)⑤为Si元素,其最高正价为+4;
(2)根据同一主族,原子序数越大,金属性越强,同一周期中,原子序数越大,金属性越弱进行判断;
(3)氢和氧元素可以形成水和双氧水;
(4)同一周期中,原子序数越大,原子半径越小;④的最高价氧化物的水化物是氢氧化钠;⑥的最高价含氧酸为硫酸,硫酸与氢氧化钠反应生成硫酸钠和水.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为O、④为Na、⑤为Si、⑥为S、⑦为Cl,
(1)⑤为硅元素,元素符号为:Si,硅的最外层含有4个电子,其最高正化合价为+4,
故答案为:Si;+4;
(2)①~⑦中金属性最强的是Na元素;⑥为S、②为C,由于H2SO4为强酸、H2CO3为弱酸,则S的非金属性比C强,
故答案为:Na;H2SO4为强酸、H2CO3为弱酸(合理即可);
(3)①、③分别为H、O元素,二者形成的化合物为:H2O、H2O2,
故答案为:H2O;H2O2;
(4)Na、S和Cl位于同一周期,原子序数越大,原子半径越小,则原子半径大小为:Na>S>Cl;
④为Na,其最高价氧化物的水化物是NaOH;⑥的最高价含氧酸为硫酸,硫酸与氢氧化钠反应生成硫酸钠和水,反应的离子方程式为:H++OH-=H2O,
故答案为:Na>S>Cl;NaOH;H++OH-=H2O.
点评 本题考查了元素周期表和元素周期律的综合应用,题目难度中等,熟练掌握原子结构与元素周期表、元素周期律的关系为解答关键,试题侧重考查学生的分析、理解能力及灵活应用 基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
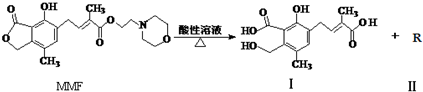
| A. | 1molMMF与足量NaOH 溶液共热,最多可消耗5molNaOH | |
| B. | 可以用NaHCO3溶液区别MMF与化合物Ⅰ | |
| C. | 化合物 R的分子式为C6H13NO2 | |
| D. | 一个MMF分子中含有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气 | B. | 天然气 | C. | 一氧化碳 | D. | 水煤气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知BF3键角为120°,则SnBr2键角小于120° | |
| B. | SO2是直线型分子 | |
| C. | PCl5是三角锥形分子 | |
| D. | 四氨合铜离子中铜离子的配位数为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
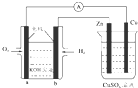
| A. | 该装置中Zn极为阳极 | |
| B. | 一段时间后铜片上质量增加 | |
| C. | a极反应的电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 当铜极的质量变化为32g时,b极上消耗的O2的体积为11.2 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com