
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 标准状况下,22.4LCCl4中所含C—C1键的数目为4NA
B. 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
C. 向密闭容器中充入1molN2O4,加热使之充分分解,生成NO2的分子数为2NA
D. 7.8gNa2O2中阴离子所含的电子数为1.8NA
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源:2016-2017学年福建省三明市高二下学期第一次月考化学试卷(解析版) 题型:选择题
甲-辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断正确的是

A. 金属性:甲>乙>丁
B. 辛是金属元素,元素符号为Ge
C. 丙和庚的原子核外电子数相差13
D. 乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源:2017届河北省张家口市高三第一学期期末教学质量监测化学试卷(解析版) 题型:简答题
乙苯(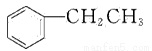 )在有机合成中占有重要的地位,有着广泛的用途。
)在有机合成中占有重要的地位,有着广泛的用途。
已知:
①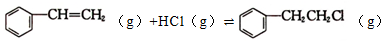 ΔH1=-54kJ·mol-1。
ΔH1=-54kJ·mol-1。
②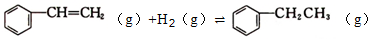 ΔH2=-121kJ·mol-1。
ΔH2=-121kJ·mol-1。
③H2(g)+Cl2(g)=2HCl(g) ΔH3=-185kJ·mol-1。
④相关化学键的键能数据如表所示。
化学键 | C—H | C—C | C=C | C—Cl | H—Cl |
键能/(kJ·mol-1) | 412 | 348 | x | 341 | 432 |
请回答:
(1)根据化学反应原理,缩小容器容积对反应②的影响为________。
(2)根据反应①和表中数据计算,x=________。
(3)
①ΔH4=________。
②该反应正、逆反应平衡常数与温度的关系如图所示,其中表示正反应平衡常数K正的曲线为________(填“A”或“B”),理由为________。
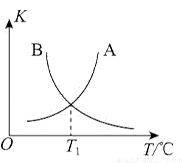
④T1℃时,该反应的平衡常数K=________。该温度下,起始向容积为10L的容积可变的密闭容器中充入1mol (g)、2molCl2(g)、1mol
(g)、2molCl2(g)、1mol (g)、2molHCl(g),则开始时,v正________(填“>”“<”或“=”)v逆。
(g)、2molHCl(g),则开始时,v正________(填“>”“<”或“=”)v逆。
查看答案和解析>>
科目:高中化学 来源:2017届河北省张家口市高三第一学期期末教学质量监测化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 溶液和胶体的本质区别为是否能产生丁达尔效应
B. K2Cr2O7溶液和氢溴酸能存放于同一药品橱内
C. 用带玻璃塞的细口试剂瓶保存氢氟酸
D. CH4和C2H4均属于常用危险品中的易燃气体
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期第二次质检考试理科综合化学试卷(解析版) 题型:选择题
滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。用0.10mol·L-1NaOH溶液滴定0.10mol·L-1H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是( )
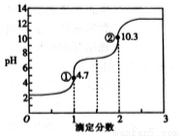
A. H2C2O4属于二元弱酸
B. 若用NaOH标准溶液滴定NaHC2O4溶液,可用酚酞作指示剂
C. 图中①处: c(Na+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
D. 图中②处:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市、洪都中学、麻丘中学、十七中、桑海中学高二3月联考化学试卷(解析版) 题型:填空题
白藜芦醇的结构简式为: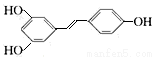 ,根据要求回答问题:
,根据要求回答问题:
(1)白藜芦醇的分子式为____________________。
(2)白藜芦醇所含官能团的名称为____________________。
(3)下列关于白藜芦醇的分类判断正确的是____________________。
A.它属于链状烯烃 B.它 属于脂环化合物 C.它属于芳香化合物 D.它属于烃的衍生物
属于脂环化合物 C.它属于芳香化合物 D.它属于烃的衍生物
(4)具备下列条件的白藜芦醇的同分异构体有______________种。
①碳的骨架和官能团种类不变 ②两个苯环上都有官能团 ③仅改变含氧官能团的位置
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市、洪都中学、麻丘中学、十七中、桑海中学高二3月联考化学试卷(解析版) 题型:选择题
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2的化合物( )
A. 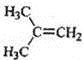
B. 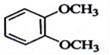
C. 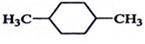
D. 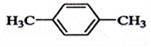
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市北校区高一下学期第一次月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如下图所示,下列说法正确的是
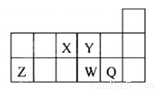
A. 离子Y2-和Z3+的核外电子数和电子层数都不相同
B. 原子半径的大小顺序为rX>rY>rZ>rW>rQ
C. 元素X与元素Z的最高正化合价之和的数值等于8
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:简答题
工业废水中常含有一定量Cr2O72-和CrO42-,它们会对人类及生态系统产生很大伤害。
已知:i. 2CrO42-(黄色)+ 2H+  Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O
ii. Cr(OH)3(s) + H2O  [Cr(OH)4]- (亮绿色) + H+
[Cr(OH)4]- (亮绿色) + H+
(1) 含铬工业废水的一种处理流程如下:

① i. 若在转化一步中调节溶液的pH=2,则溶液显_______色。
ii. 能说明转化一步反应达平衡状态的是_______(填字母序号)。
a.Cr2O72-和CrO42-的浓度相同 b.ν正(Cr2O72-) = 2ν逆(CrO42-)
c.溶液的颜色不变 d.溶液的pH不变
② 步骤②还原一步的离子方程式是___________________________;若还原l mol Cr2O72-离子,需要FeSO4·7H2O的物质的量是_______mol。
③ 沉淀一步中,向含Cr3+(紫色)溶液中,逐渐滴加NaOH溶液。当pH=4.6时,开始出现灰绿色沉淀,随着pH的升高,沉淀量增多。当pH≥13时,沉淀逐渐消失,溶液变为亮绿色。
i. 请解释溶液逐渐变为亮绿色的原因:_______。
ii. 若向0.05mol·L-1的Cr2(SO4)3溶液50mL中,一次性加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象是__________。
④ 在K[Cr(OH)4]和K2Cr2O7混合溶液中加入足量H2SO4酸化,铬元素以_______形式存在(填离子符号)。
(2) 用Fe做电极电解含Cr2O72-的酸性工业废水,可以直接除去铬。随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
① 结合上述工业流程分析用Fe做电极的原因:_______。
② 结合电极反应式解释在阴极附近溶液pH升高的原因:_______。
③ 溶液中同时生成的沉淀可能还有_______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com