


科目:高中化学 来源: 题型:阅读理解



| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
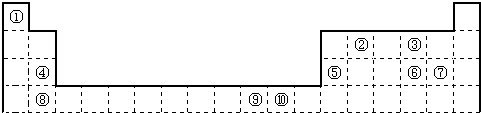
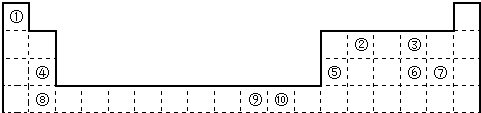
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ |

| M | ||
4
|
| M | ||
4
|
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com