
| A | |||
| B | C | D |

| 3.36L |
| 22.4L/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、H2SO4和H3PO4的摩尔质量相等 |
| B、在标准状况下18g水的体积约为22.4L |
| C、1molH2所占的体积约为22.4L |
| D、通常状况下,NA个 CO2分子占有的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若溶液中部分粒子间满足:c(CH3COO-)=c(Na+) 则该溶液一定呈中性 |
| B、溶液中四种离子之间不可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、若溶液中粒子间满足:c(CH3COO-)>c( Na+)>c(H+)>c(OH-),则溶液中溶质一定是CH3COONa和CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中可能含K+ |
| B、该溶液中肯定含有NO3?、SO42-、NH4+、CO32- |
| C、该溶液中一定不含NH4+ |
| D、该溶液中一定含K+,且c(K+)≥0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验事实 | 结论描述 | |
| ① | 18g某有机物完全燃烧,只得到26.4gCO2和10.8gH2O | 最简式 |
| ② | 该有机物的相对分子质量为180 | 分子式 |
| ③ | 一定条件下,180g该有机物与乙酸完全熔化,生成乙酸酯的质量为390g | 一个分子中有 |
| ④ | 该有机物可以发生银镜反应 | 含官能团 |
| ⑤ | 该有机物可以被还原为直链己六醇 | 分子结构中 |
| 该有机物结构简式 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b=c |
| B、A=b>c |
| C、b>a>c |
| D、c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、b<f |
| B、915℃、2.0MPa时E的转化率为50% |
| C、该反应的△S>0 |
| D、K(1000℃)>K(810℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:
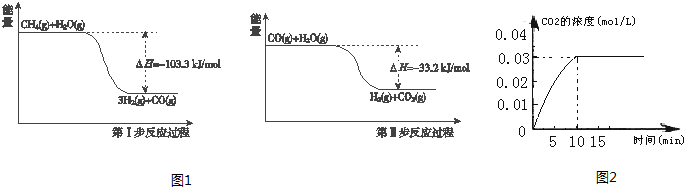
查看答案和解析>>
科目:高中化学 来源: 题型:
235 92 |
235 92 |
A、
| ||||||
B、可利用
| ||||||
C、利用化学反应把
| ||||||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com