
下列对于某些离子的检验说法中正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32—
B.某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红气体,说明原溶液中存在NH4+
C.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42—
D.可用焰色反应实验检验溶液中是否含有K+
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
在T℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第三次月考化学试卷(解析版) 题型:选择题
Fenton试剂常用于氧化降解有机污染物X。在一定条件下,反应初始时c(X)=2.0×10-3 mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是
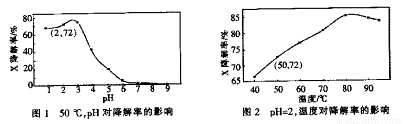
A.50oC,PH在3~6之间,X降解率随pH增大而减小
B.pH=2,温度在40~80 oC,X降解率随温度升高而增大
C.无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80 oC
D.pH=2、温度为50oC,10min内v(X)=1.44x10-4mol·L-1min-1
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省等四校高一上学期期中联考化学试卷(解析版) 题型:实验题
(一)下图所示为常见气体的制备、除杂、性质验证和尾气处理等实验的仪器装置(加热设备及部分夹持固定装置已略去)。请根据要求完成下列各题。
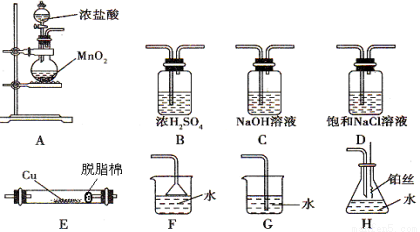
(1)若实验室制取纯净、干燥的Cl2,并进行检验其和铜的反应。所选装置的顺序依次为(从左向右)
(2)A中发生反应的化学方程式为 ;
(3)实验过程中,先点燃 (写字母编号)处的酒精灯,观察到什么现象_______再点燃 (写字母编号)处的酒精灯。E管中的反应现象
(二)化学反应的产物往往跟反应条件密切相关,下图中:
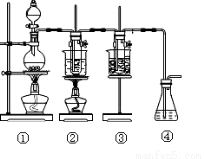
①为氯气发生装置;
②的试管里盛有15 mL 4mol/L NaOH溶液,并置于水浴中;
③的试管里盛有15 mL 0.5mol/LNaOH溶液,并置于冰水浴中;
④为尾气吸收装置。
实验结果表明②中有氯酸钠生成③中有次氯酸钠生成。
(4)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ;
② 。
(5)反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。

(三)(6)若实验中大约需要225mL0.5mol/L的NaOH溶液,至少需要称量NaOH固体___________g,现有可供选择的仪器:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥500mL容量瓶 ⑦托盘天平 。配制上述溶液还需提供的仪器有____________________
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省等四校高一上学期期中联考化学试卷(解析版) 题型:选择题
向盛有一定量Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示,主要与溶液中可自由移动的离子浓度有关)近似可用下图中的哪条曲线表示

查看答案和解析>>
科目:高中化学 来源:2014-2015福建省等四校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列各组物质,按化合物、单质、混合物顺序排列的是
A.生石灰、白磷、熟石灰 B.空气、氮气、胆矾
C.干冰、铁、氯化氢 D.烧碱、水银、碘酒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应为吸热反应
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:填空题
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:
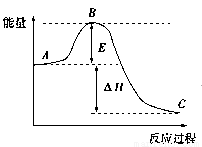
(1)图中A、C分别表示:_________________、__________________;
E的大小对该反应的反应热有无影响?_______________________;
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_____________;
理由是__________________________________________。
(2)图中ΔH=______________kJ/mol,该反应是______________反应(填“吸热”“放热”)。
(3)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”)。
(4)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol;
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
试计算1 mol肼和二氧化氮完全反应时放出的热量为_______________kJ,写出肼与二氧化氮反应的热化学方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com