
| A. | HClO | B. | HNO3 | C. | Ca(HCO3)2 | D. | NaNO3 |
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
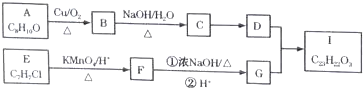
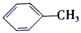 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$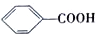
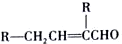
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
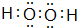 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的某二元弱碱的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 25℃时,pH=12的氨水和pH=12的盐酸等体积混合:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| C. | 等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合:c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO${\;}_{4}^{2-}$)+c(NH${\;}_{4}^{+}$)+c(H+)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ | |
| C. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6,显弱酸性 | B. | [H+]=10-6mo1•L-1,溶液为中性 | ||
| C. | [OH-]=10-6mo1•L-1,溶液为碱性 | D. | 温度不变稀释10倍,pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液和氢氧化钠溶液混合 HCO3-+OH-═CO32-+H2O | |
| B. | 向氯化铁溶液中投入铜粉 Cu+Fe3+═Fe2++Cu2+ | |
| C. | 少量的二氧化碳通入次氯酸钙溶液 Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓ | |
| D. | 铜与稀硝酸反应 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将28.4g Na2SO4溶于水配成1000mL溶液,溶液中c (Na+)的物质的量浓度为0.2mol/L | |
| B. | 80 mL 1 mol•L-1氯化钠溶液中的c (Na+)与40 mL 1 mol•L-1碳酸钠溶液中的c (Na+) 相等 | |
| C. | 0.5 mol•L-1NaCl和0.5mol•L-1Na2SO4两溶液相比较,Na+的物质的量之比为1:2 | |
| D. | 4 mol•L-1的NaCl溶液稀释成100 mL 0.2molL-1的NaCl溶液,需4 mol•L-1的NaCl溶液的体积为5.0mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com