
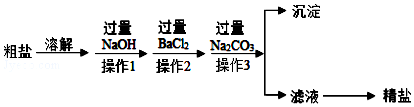
分析 根据除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4杂质,即除去镁离子、钙离子和硫酸根离子和泥沙,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,样品溶解之后,可先加入氢氧化钠除去氯化镁,再加入氯化钡除去硫酸钠,或先加入氯化钡除去硫酸钠,再加入氢氧化钠除去氯化镁,最后加入碳酸钠,以除去CaCl2和过量的BaCl2,过滤要放在所有的沉淀操作之后,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,最后户进行蒸发、结晶、烘干等操作得到精盐,以此解答该题.
解答 解:(1)操作3中,加入Na2CO3生成碳酸钡、碳酸钙沉淀,反应的化学方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl,
故答案为:CaCl2+Na2CO3═CaCO3↓+2NaCl、BaCl2+Na2CO3═BaCO3↓+2NaCl;
(2)由以上分析得操作3后所得滤液的主要成分有滤液的主要成分有:NaCl、NaOH、Na2CO3,
故答案为:NaCl、NaOH、Na2CO3;
(3)检验硫酸根离子,可用氯化钡检验,生成白色沉淀,方法是取少量上层清液置于试管中,滴加BaCl2溶液,看是否有白色沉淀生成,
故答案为:取少量上层清液置于试管中,滴加BaCl2溶液,看是否有白色沉淀生成;
(4)滤液的主要成分有:NaCl、NaOH、Na2CO3,故向滤液中加入适量的稀盐酸以除去氢氧化钠和碳酸钠,故这种试剂是稀盐酸,
故答案为:稀盐酸;
(5)在操作4中,需要进行蒸发,当蒸发时有大量固体析出时,需要停止加热,利用余热把剩余固体蒸干,
故答案为:停止加热,利用余热把剩余固体蒸干;
(6)氯化钡溶液和氢氧化钠溶液的顺序可以颠倒,所以添加沉淀试剂的步骤为:BaCl2、NaOH、Na2CO3,
故答案为:BaCl2、NaOH、Na2CO3.
点评 本题考查物质分离、提纯实验方案的设计,为高考常见题型,侧重于学生的分析、实验能力的考查,把握流程中试剂的加入发生的化学反应及操作为解答的关键,注重实验的严密性和溶液的配制、物质提纯的考查,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
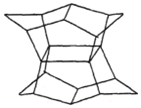 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )| A. | 分子式为C20H20 | B. | 一氯代物的同分异构体只有两种 | ||
| C. | 分子中含有4个亚甲基(-CH2-) | D. | 分子中含有12个五元碳环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式为 N:::N | B. | CH4分子的球棍模型: | ||
| C. | HClO的结构式为H-O-Cl | D. | 氟离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
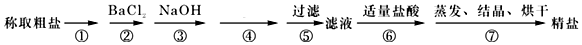
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
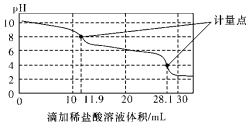 实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1mol•L-1盐酸进行滴定,得到如图曲线.以下说法或操作正确的是( )
实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1mol•L-1盐酸进行滴定,得到如图曲线.以下说法或操作正确的是( )| A. | 上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| B. | 下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- | |
| C. | 此样品n(NaHCO3)=(28.1-2×11.9)×10-4 mol | |
| D. | 使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com