
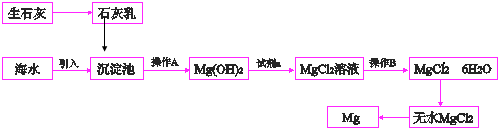
 £®
£®·ÖĪö ÓÉĮ÷³ĢæÉÖŖ£¬ÉśŹÆ»ŅČÜÓŚĖ®Éś³ÉĒāŃõ»ÆøĘ£¬¼ÓČėŗ£Ė®ÖŠ³ĮµķĆ¾Ąė×ÓÉś³ÉĒāŃõ»ÆĆ¾³Įµķ£¬²Ł×÷AĪŖ¹żĀĖ£¬¹żĀĖŗó¼ÓČėŹŌ¼ĮaĪŖŃĪĖį£¬·“Ó¦µĆµ½ĀČ»ÆĆ¾ČÜŅŗ£¬²Ł×÷BĪŖÕō·¢ÅØĖõĄäČ“½į¾§£¬µĆµ½ĀČ»ÆĆ¾¾§Ģ壬ŅņĀČ»ÆĆ¾Ė®½āÉś³ÉµÄŃĪĖįŅ×»Ó·¢£¬ŌņŌŚĀČ»ÆĒāĘųĮ÷ÖŠ¼ÓČČŹ§Č„½į¾§Ė®µĆµ½ĀČ»ÆĆ¾¹ĢĢ壬×īŗóµē½āČŪČŚĀČ»ÆĆ¾µĆµ½½šŹōĆ¾£¬ŅŌ“ĖĄ“½ā“š£®
£Ø1£©øł¾ŻĆ¾Ąė×ÓÄÜÓėĒāŃõøłĄė×Ó·“Ӧɜ³É³ĮµķĄ“Č·¶ØĒāŃõ»ÆøʵÄ×÷ÓĆ£»
£Ø2£©øł¾Żŗ£Ńó²śĘ·ÖŠÓėŹÆ»ŅŹÆĻąĶ¬µÄĪļÖŹ½ųŠŠ½ā“š£»
£Ø3£©øł¾Ż¹żĀĖµÄŌĄķŗĶĮłĖ®ŗĻĀČ»ÆĆ¾¾§ĢåµÄĢŲµć½ā“š£»
£Ø4£©ĒāŌ×Ó×īĶā²ć1øöµē×Ó£¬ĀČŌ×Ó×īĶā²ć7øöµē×Ó£¬HCl·Ö×ÓŹĒÓÉ1øöĒāŌ×ÓŗĶ1øöĀČŌ×ÓĶعż¹²ÓĆ1¶Ōµē×Ó½įŗĻ¶ų³ÉµÄ¹²¼Ū»ÆŗĻĪļ£»
£Ø5£©øł¾Żµē½āµÄŌĄķ½ā“šĀČĄė×ÓŌŚŃō¼«Ź§µē×ÓÉś³ÉĀČĘų£¬Ņõ¼«ÉĻĆ¾Ąė×ӵƵ½µē×ÓÉś³É½šŹōĆ¾£¬øł¾ŻĮ÷³ĢĶ¼ĶĘ²āø±²śĪļĀČĘųµÄÓĆĶ¾£»
£Ø6£©ĀČ»ÆĆ¾ČÜŅŗÕō·¢ÅØĖõ¹ż³ĢÖŠ£¬Ć¾Ąė×ÓĖ®½ā±»“Ł½ųµĆµ½ĒāŃõ»ÆĆ¾£¬ĪŖŅÖÖĘĆ¾Ąė×ÓµÄĖ®½āŠčŅŖ¼ÓČėŃĪĖį£®
½ā“š ½ā£ŗÓÉĮ÷³ĢæÉÖŖ£¬ÉśŹÆ»ŅČÜÓŚĖ®Éś³ÉĒāŃõ»ÆøĘ£¬¼ÓČėŗ£Ė®ÖŠ³ĮµķĆ¾Ąė×ÓÉś³ÉĒāŃõ»ÆĆ¾³Įµķ£¬²Ł×÷AĪŖ¹żĀĖ£¬¹żĀĖŗó¼ÓČėŹŌ¼ĮaĪŖŃĪĖį£¬·“Ó¦µĆµ½ĀČ»ÆĆ¾ČÜŅŗ£¬²Ł×÷BĪŖÕō·¢ÅØĖõĄäČ“½į¾§£¬µĆµ½ĀČ»ÆĆ¾¾§Ģ壬ŅņĀČ»ÆĆ¾Ė®½āÉś³ÉµÄŃĪĖįŅ×»Ó·¢£¬ŌņŌŚĀČ»ÆĒāĘųĮ÷ÖŠ¼ÓČČŹ§Č„½į¾§Ė®µĆµ½ĀČ»ÆĆ¾¹ĢĢ壬×īŗóµē½āČŪČŚĀČ»ÆĆ¾µĆµ½½šŹōĆ¾£¬
£Ø1£©Ć¾Ąė×ÓÄÜÓėĒāŃõøłĄė×Ó·“Ӧɜ³ÉĒāŃõ»ÆĆ¾³Įµķ£ŗMg2++Ca£ØOH£©2ØTMg£ØOH£©2+Ca2+£¬Š“Ąė×Ó·½³ĢŹ½Ź±ĒāŃõ»ÆĆ¾³ĮµķŠ“»ÆѧŹ½£¬
¹Ź“š°øĪŖ£ŗ³ĮµķMg2+£Ø»ņŹ¹Mg2+ŠĪ³ÉMg£ØOH£©2³Įµķ£©£»Mg2++Ca£ØOH£©2ØTMg£ØOH£©2+Ca2+£»
£Ø2£©±“æĒ»ņĵņĆæĒµÄÖ÷ŅŖ³É·ÖĪŖĢ¼ĖįøĘ£¬¹Ź“š°øĪŖ£ŗ±“æĒ£Ø»ņĵņĆæĒµČ£©£»
£Ø3£©·ÖĄė²»ČÜÓŚĖ®µÄ¹ĢĢåŗĶŅŗĢ壬æÉÓĆ¹żĀĖµÄ·½·Ø£¬“Ó³Įµķ³ŲÖŠµĆµ½ĒāŃõ»ÆĆ¾ÓĆ¹żĀĖµÄ·½·Ø£¬“ÓĀČ»ÆĆ¾ČÜŅŗÖŠµĆµ½ĮłĖ®ŗĻĀČ»ÆĆ¾£¬·Ą½į¾§Ė®ĖšŹ§£¬Ķعż¼ÓČČÅØĖõ»ņÕō·¢½į¾§µÄ·½·Ø»ńµĆĮłĖ®ŗĻĀČ»ÆĆ¾£¬
¹Ź“š°øĪŖ£ŗ¹żĀĖ£» ¼ÓČČÅØĖõ£Ø»ņÕō·¢½į¾§£©£»
£Ø4£©“ÓĒāŃõ»ÆĆ¾µ½ĀČ»ÆĆ¾£¬ĒāŃõ»ÆĆ¾ŗĶŃĪĖį·“Ó¦µĆµ½ĀČ»ÆĆ¾ŗĶĖ®£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗMg£ØOH£©2+2HCl=MgCl2+2H2O£¬¼ÓČėµÄ×ćĮæŹŌ¼ĮaŹĒHCl£¬HCl·Ö×ÓŹĒÓÉ1øöĒāŌ×ÓŗĶ1øöĀČŌ×ÓĶعż¹²ÓĆ1¶Ōµē×Ó½įŗĻ¶ų³ÉµÄ¹²¼Ū»ÆŗĻĪļĘäµē×ÓŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø5£©ĪŽĖ®MgCl2ŌŚČŪȌדĢ¬ĻĀ£¬ĶصēŗóŃō¼«ĀČĄė×ÓŹ§Č„µē×ÓÉś³ÉĀČĘų£¬Ņõ¼«Ć¾Ąė×ӵƵ½µē×ÓÉś³ÉĆ¾µ„ÖŹ£¬ĖłŅŌĀČ»ÆĆ¾µē½ā»į²śÉśMgŗĶCl2£¬ø±²śĪļĀČĘųŗĶĒāĘų·“Ӧɜ³ÉĀČ»ÆĒā£¬ÄÜŃ»·Ź¹ÓĆ£¬
¹Ź“š°øĪŖ£ŗĀČĘų£»Ć¾£»MgCl2£ØČŪČŚ£© $\frac{\underline{\;Ķصē\;}}{\;}$Mg+Cl2”ü£»ÖĘŃĪĖį£¬Ń»·Ź¹ÓĆ£»
£Ø6£©ĀČ»ÆĆ¾ČÜŅŗÕō·¢ÅØĖõ¹ż³ĢÖŠ£¬Ć¾Ąė×ÓĖ®½ā±»“Ł½ųµĆµ½ĒāŃõ»ÆĆ¾£¬Mg2++2H2O?Mg£ØOH£©2+2H+£¬ĪŖŅÖÖĘĆ¾Ąė×ÓµÄĖ®½āŠčŅŖ¼ÓČėŃĪĖį£¬
¹Ź“š°øĪŖ£ŗMg2++2H2O?Mg£ØOH£©2+2H+£»¼ÓČėŃĪĖįŅÖÖĘĆ¾Ąė×ÓµÄĖ®½ā£®
µćĘĄ ±¾Ģāæ¼²éĮĖ“Óŗ£Ė®ÖŠĢįČ”Ć¾µÄ·“Ó¦ŌĄķ£¬ĄūÓĆĖłŃ§ÖŖŹ¶½įŗĻĮ÷³ĢĶ¼ŠÅĻ¢ŹĒ½ā“š±¾ĢāµÄ¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H3PO2ČÜÓŚĖ®µÄµēĄė·½³ĢŹ½ĪŖ£ŗH3PO2?3H++PO23- | |
| B£® | H3PO2Óė¹żĮæNaOHČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗH3PO2+3OH-=PO23-+3H2O | |
| C£® | ½«H3PO2ČÜŅŗ¼ÓČėµ½ĖįŠŌøßĆĢĖį¼ŲČÜŅŗÖŠ£¬H3PO2µÄ»¹Ō²śĪļĪŖH3PO4 | |
| D£® | ÓƶčŠŌµē¼«µē½āNaH2PO2ČÜŅŗ£¬ĘäŃō¼«·“Ó¦Ź½ĪŖ£ŗH2PO2-4e-+2H2O=O2”ü+4H+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¶ØŠŌ¼ģŃéSO32-£¬æÉÓĆHNO3Ėį»ÆµÄBaCl2ČÜŅŗ | |
| B£® | ÅäÖĘFeCl2ČÜŅŗŹ±Ķس£¼ÓÉŁĮæHNO3Ėį»Æ£¬¼õŠ”ĘäĖ®½ā³Ģ¶Č | |
| C£® | ¼ģŃéijČÜŅŗÖŠŹĒ·ńŗ¬Cl-£¬ÓĆHNO3Ėį»ÆµÄAgNO3ČÜŅŗ | |
| D£® | ¼ģŃéŃõ»ÆĢśÖŠµÄŃõ»ÆŃĒĢś£¬ĻČÓĆĮņĖįČÜŅŗČܽā£¬Č»ŗó¼ÓČėŃĪĖįĖį»ÆµÄøßĆĢĖį¼ŲČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¾ßÓŠĻąĶ¬ŹżÄæµÄŌ×Ó | B£® | ¶¼Õ¼22.4 L | ||
| C£® | ¾ßÓŠĻąĶ¬ŹżÄæµÄ·Ö×Ó | D£® | ¾ßÓŠĻąĶ¬µÄÖŹĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | m=aVd | B£® | a%=£ØcM/1 0d£©% | C£® | c=1 000mVM | D£® | c=1 000daM |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
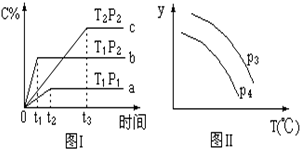
| A£® | P3£¼P4£¬yÖį±ķŹ¾AµÄ×Ŗ»ÆĀŹ | |
| B£® | P3£¼P4£¬yÖį±ķŹ¾BµÄĢå»ż·ÖŹż | |
| C£® | P3£¼P4£¬yÖį±ķŹ¾»ģŗĻĘųĢåµÄĆÜ¶Č | |
| D£® | P3£¾P4£¬yÖį±ķŹ¾»ģŗĻĘųĢåµÄĘ½¾łÄ¦¶ūÖŹĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼µÄČ¼ÉÕČČ110.5 kJ/mol | |
| B£® | ¢ŁµÄ·“Ó¦ČČĪŖ221 kJ/mol | |
| C£® | Ļ”“×ĖįÓėĻ”NaOHČÜŅŗ·“Ӧɜ³É1mol H2OŹ±¶ŌÓ¦µÄ·“Ó¦ČČĪŖ-57.3 kJ/mol | |
| D£® | Ļ”ŃĪĖįÓėĻ”NaOHČÜŅŗ·“Ӧɜ³É1mol H2OŹ±¶ŌÓ¦µÄ·“Ó¦ČČĪŖ-57.3 kJ/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com