
已知下列反应,(反应所需的其他条件和各物质的化学计量数均已略去):
① A+B M+D+E; ② M+E?A+F+B
M+D+E; ② M+E?A+F+B
请针对以下两种不同情况回答:
(1)若A是一种钠盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为 ;反应②的离子方程式为 ;在酸性条件下,若将化合物F加到Fe2+的溶液中,溶液从浅绿色变成黄色,反应的离子方程式为 。
(2)若A是一种含氧酸盐,可用于实验室中检验水的存在。1个A的酸根离子中共含有50个电子,其中含有一种元素X,X的原子的最外层电子数是电子层数的2倍,则X在元素周期表中的位置是 周期____族。X单质的熔点是112?8?C,则X单质的晶体类型属于 晶体。X与碳单质在一定条件下可以生成CX2的化合物,其分子结构类似于CO2,则CX2属于 分子(填“极性”或“非极性”)。反应②的化学方程式为: ;
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源:2015-2016学年河北邯郸魏县一中、曲周县一中高二上期中化学试卷(解析版) 题型:选择题
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
A.相同条件下,MnS的Ksp比CuS的Ksp大
B.该反应的平衡常数K=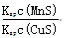
C.该反应达到平衡时c(Mn2+)=c(Cu2+)
D.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
查看答案和解析>>
科目:高中化学 来源:2016届北京一五六中学上学期高三期中考试化学试卷(解析版) 题型:实验题
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
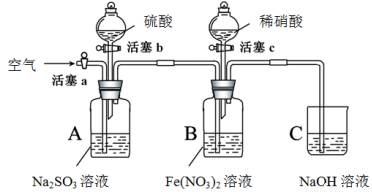
实验记录如下:
实验操作 | 实验现象 | |
I | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
II | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色。 |
III | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
IV | 一段时间后,用注射器取出少量B装置中的溶液,…… | …… |
V | 打开活塞a,通入一段时间空气 | ———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2+ + NO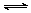 [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016届北京一五六中学上学期高三期中考试化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物
B.SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水
C.FeO、Fe2O3均为碱性氧化物,与氢碘酸反应均只发生复分解反应
D.将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙
查看答案和解析>>
科目:高中化学 来源:2016届北京西城(南区)重点中学高三第一学期课堂综合练习化学试卷(解析版) 题型:选择题
下列离子反应方程式书写正确的是
A.氯气与水反应:Cl2 + H2O = Cl- + 2H+ + ClO-
B.氨气通入醋酸溶液中:NH3 + H+ = NH4+
C.制备Fe(OH)3胶体:Fe3+ + 3H2O Fe(OH)3(胶体) + 3H+
Fe(OH)3(胶体) + 3H+
D.碳酸氢钠溶液中加入过量石灰水:HCO3- + OH- = CO32- + H2O
查看答案和解析>>
科目:高中化学 来源:2016届北京市高三第一学期课堂综合练习化学试卷(解析版) 题型:选择题
在25 ℃时,将pH=11的NaOH溶液a mL 与pH=1的H2SO4溶液b mL混合, 当恰好完全中和时, a 与b的比值为
A.1000:1 B.100:1 C.50:1 D.10:1
查看答案和解析>>
科目:高中化学 来源:2016届北京东城(南区)重点中学高三第一学期课堂综合练习化学试卷(解析版) 题型:选择题
在1000 mL含有等物质的量的HBr和H2SO3溶液中通入0.01 molCl2,有一半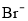 变为Br2,原溶液中HBr和H2SO3的浓度都等于
变为Br2,原溶液中HBr和H2SO3的浓度都等于
A.0.007 5 mol·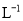 B.0.008 mol·
B.0.008 mol·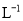 C.0.075 mol·
C.0.075 mol·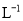 D.0.08 mol·
D.0.08 mol·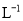
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上学期期中考试化学试卷(解析版) 题型:选择题
用NA表示阿伏德罗常数,下列叙述正确的是
A.1.8g的NH4+离子中含有电子数11NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl- 个数为1 NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第三次月考化学试卷(解析版) 题型:填空题
Ⅰ、现有A g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子的个数为________________个。
(2)该气体在标准状况下的密度为_______________ g/L。
(3)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________________mol/L。
Ⅱ、已知食盐常加人KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4 3K2SO4+3I2+3H2O
3K2SO4+3I2+3H2O
(1)如果反应中转移0.2mol电子,则生成I2的物质的量为 mol。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)
若反应中消耗Cl2 1.5 mol,则被氧化的NH3在标准状况下的体积为______ L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com