
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
分析 实验室制备1,2-二溴乙烷的反应原理为:A装置中乙醇发生消去反应生成乙烯:CH3CH2OH$\frac{\underline{\;H_{2}SO_{4}\;}}{170℃}$CH2=CH2↑+H2O,B装置可以作安全瓶,要以防倒吸,由于有副反应的发生,生成的乙烯中有酸性气体,所以C装置用氢氧化钠吸收乙烯中的酸性杂质气体,然后乙烯与溴发生加成反应生成1,2-二溴乙烷:CH2=CH2+Br2→BrCH2CH2Br,产物中混有的溴单质可以用氢氧化钠溶液除去,粗产品分离提纯时可通过水洗除去无机杂质,再通过蒸馏除去乙醚,整个操作流程还要乙醇发生消去反应时温度的控制,防止副产品乙醚的生成,以及乙烯加成时防溴挥发等;
(1)乙醇在浓硫酸140℃的作用下发生分子间脱水;
(2)浓硫酸具有强氧化性,可能氧化乙醇中的碳,因此乙烯中可能混有CO2和SO2酸性气体,可通过装置C中的溶液除去;
(3)乙烯和溴水发生了加成反应,溴水是橙红色,如果反应完全将变为无色;
(4)水洗静置分层后可根据1,2-二溴乙烷和水的密度相对大小来判断产物和水层;
(5)相互混溶的液体混合物,可利用1,2-二溴乙烷与乙醚的沸点不同选择分离方法;
(6)该反应放热,溴易挥发,降温的目的是防止挥发,但1,2-二溴乙烷熔点较低,温度过低易凝固会堵塞导管.
解答 解:实验室制备1,2-二溴乙烷的反应原理为:A装置中乙醇发生消去反应生成乙烯:CH3CH2OH$\frac{\underline{\;H_{2}SO_{4}\;}}{170℃}$CH2=CH2↑+H2O,B装置可以作安全瓶,要以防倒吸,由于有副反应的发生,即浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,生成的乙烯中有二氧化碳、二氧化硫等酸性气体,所以C装置用氢氧化钠吸收乙烯中的酸性杂质气体,然后乙烯与溴发生加成反应生成1,2-二溴乙烷:CH2=CH2+Br2→BrCH2CH2Br,产物中混有的溴单质可以用氢氧化钠溶液除去,
(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,故答案为:d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,故答案为:c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,故答案为:下;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,故答案为:蒸馏;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
点评 该题较为综合,主要考查了乙醇制备1,2-二溴乙烷,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
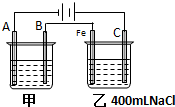 如图为相互串联的甲、乙两电解池试回答:
如图为相互串联的甲、乙两电解池试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol•L-1 | 5.0 | 3.5 | 2.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.
“低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(C1O2)气体是一种常用高效的自来水消毒剂.
二氧化氯(C1O2)气体是一种常用高效的自来水消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g O2占有的体积约为22.4 L | |
| B. | 常温常压下,28g N2含有阿伏加德罗常数个氮气分子 | |
| C. | 在标准状况下,22.4 L水的质量约为18 g | |
| D. | 标准状况下22 g二氧化碳气体与标况下的11.2 L HCl气体含有的分子数不一样多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com