
| n |
| V |
| n |
| V |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:

| A、图1,燃气灶的中心部位发生的是吸氧腐蚀 |
| B、图2,海水中的铁棒,插入海水中的部分腐蚀会更加严重 |
| C、图3,在烧杯中滴加几滴KSCN溶液,溶液不会变红色 |
| D、图4,属于牺牲阳极的阴极保护法,不可用镁作阳极来防止地下钢铁管道的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
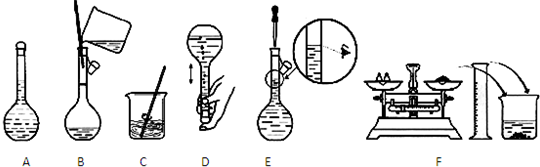
A、 酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
B、 实验室制乙炔并验证其性质 |
C、 实验室中分馏石油 |
D、 分离碘酒中的碘和酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.查看答案和解析>>
科目:高中化学 来源: 题型:
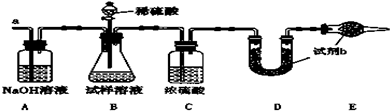
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 75pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有5种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质部分性质 | 密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-196.0℃不能导电 | 密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com