
 .
. .
. 分析 取0.3mol甲在足量氧气中完全燃烧后,生成1.5molCO2和1.8molH2O,则甲、C、H个数之比=0.3mol:1.5mol:3.6mol=1:5:12,该分子中含有5个C原子、12个H原子,因为80<Mr(甲)<100,所以O原子个数1,则甲的分子式为C5H12O;
甲的核磁共振氢谱有两个峰,说明含有两种氢原子,峰面积之比为3:1,说明两种类型的氢原子个数之比为3:1,所以甲的结构简式为(CH3)3COCH3;
烯烃丙与水加成可生成乙,乙为甲的同分异构体,红外光谱显示乙中有-OH和对称的-CH2-、-CH3等,则乙结构简式为CH3CH2CH(OH)CH2CH3、丙结构简式为CH3CH=CHCH2CH3,据此分析解答.
解答 解:取0.3mol甲在足量氧气中完全燃烧后,生成1.5molCO2和1.8molH2O,则甲、C、H个数之比=0.3mol:1.5mol:3.6mol=1:5:12,该分子中含有5个C原子、12个H原子,因为80<Mr(甲)<100,所以O原子个数1,则甲的分子式为C5H12O,甲的相对分子质量=5×12+12×1+1×16=88;
甲的核磁共振氢谱有两个峰,说明含有两种氢原子,峰面积之比为3:1,说明两种类型的氢原子个数之比为3:1,所以甲的结构简式为(CH3)3COCH3;
烯烃丙与水加成可生成乙,乙为甲的同分异构体,红外光谱显示乙中有-OH和对称的-CH2-、-CH3等,则乙结构简式为CH3CH2CH(OH)CH2CH3、丙结构简式为CH3CH=CHCH2CH3,
(1)通过以上分析知,甲的相对分子质量为88,分子式为C5H12O,
故答案为:88;C5H12O;
(2)通过以上分析知,甲的结构简式为:(CH3)3COCH3,故答案为:(CH3)3COCH3;
(3)①丙结构简式为CH3CH=CHCH2CH3,其名称是2-戊烯,
故答案为:2-戊烯;
②乙结构简式为CH3CH2CH(OH)CH2CH3,它键线式为 ,
,
故答案为: ;
;
③乙结构简式为CH3CH2CH(OH)CH2CH3,乙同类别的同分异构体中,含有3个-CH3的结构有(CH3)3CCH2OH、CH3CH2CH(OH)(CH3)2、(CH3)2CHCH(OH)CH3,
所以一共有3种,故答案为:3;
④丙结构简式为CH3CH=CHCH2CH3,发生加聚反应生成高分子化合物,反应方程式为nCH3CH=CHCH2CH3$\stackrel{一定条件下}{→}$ ,
,
故答案为:nCH3CH=CHCH2CH3$\stackrel{一定条件下}{→}$ .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识运用能力,根据题给信息结合常见物质结构进行推断,难点是同分异构体种类判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
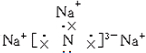 ,该化合物由离子键形成.
,该化合物由离子键形成. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油酸的分子式为C18H33O2 | B. | 油酸是乙酸的同系物 | ||
| C. | 油酸可与氢气发生加成反应 | D. | 1 mol甘油最多可与1 mol油酸酯化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
| 2 | C | D | |||||
| 3 | A | B | E | F |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 D、
D、 和
和 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-离子的结构示意图: | B. | 甲烷的结构式为: | ||
| C. | 丙烷分子的比例模型示意图: | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L氧气中,一定含有2mol氧原子 | |
| B. | 80 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L | |
| C. | 18 g水在标准状况下的体积约为22.4L | |
| D. | 标准状况下,20 mLNH3跟60 mLO2所含分子个数比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤⑦ | B. | ①⑤⑦⑧ | C. | ①⑤⑥ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com