
【题目】锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.产生气泡的速度甲比乙慢
D.两烧杯中溶液的 H+的浓度均减小
【答案】D
【解析】
甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,据此分析解答。
A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.甲中铜为正极,乙中不构成原电池,铜片不是电极,故B错误;
C.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故C错误;
D.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故D正确;
故选D。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)如图是一个化学过程的示意图。
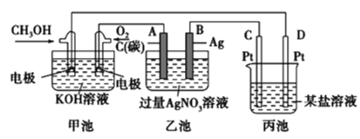
①乙池中总反应的离子方程式____________。
②电解一段时间后,向乙池的溶液中加入________________可恢复为原溶液。
③当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
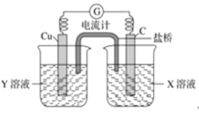
①写出负极的电极反应式:___________。
②图中X溶液是________。
③利用图中设计的原电池为电源可将雾霾中的NO、SO2电解分别转化为NH4+和SO42-,如图所示,则物质A的化学式为_____________,阴极的电极反应式为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若R元素原子的质量数为A,Rm-的核外电子数为x,则w g Rm-所含中子的物质的量为( )
A.(A-x+m) molB.(A-x-m) mol
C.![]() (A-x+m) molD.
(A-x+m) molD.![]() (A-x-m) mol
(A-x-m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(s)![]() 2Z(g) △H=-a kJ·mol-1(a>0)。一定条件下,将1mol X和2mol Y加入2L的恒容密闭容器中,反应l0min,测得Y的物质的量为1.4mol。下列说法正确的是
2Z(g) △H=-a kJ·mol-1(a>0)。一定条件下,将1mol X和2mol Y加入2L的恒容密闭容器中,反应l0min,测得Y的物质的量为1.4mol。下列说法正确的是
A. 第10min时,Z的浓度为0.7 mol-1
B. 10min内,反应放出的热量为0.3kJ
C. 10min内,X的平均反应速率为0.03 mol-1·min-1
D. 若容器中的气体密度不再发生变化,说明上述反应已达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/molB.-244.15 kJ/molC.488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为![]() +Cl2(g)
+Cl2(g)![]() +HCl(g) ΔH
+HCl(g) ΔH
在T1℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯(g)和0.40 mol Cl2(g)进行反应,反应过程中测定的部分数据见下表:
t/min | 0 | 1 | 2 | 5 | 10 |
n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
下列有关说法正确的是 ( )
A.T1℃时,反应在0~2min内的平均速率v(α-氯乙基苯)=0.05mol·L-1·s-1
B.10min后,若保持其他条件不变,升高温度至T2℃,达到新平衡时测得c(α-氯乙基苯)=0.18mol·L-1,则反应的ΔH>0
C.温度从T1℃升至T2℃时,正向反应速率增大,逆向反应速率减小
D.T1℃时,体系的总压不变时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为镍锌可充电电池放电时电极发生物质转化的示意图,电池使用KOH和K2Zn(OH)4为电解质溶液,下列关于该电池说法正确的是
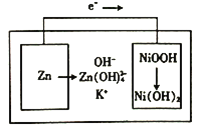
A. 放电时溶液中的K+移向负极
B. 充电时阴极附近的pH会升高
C. 放电时正极反应为H++NiOOH+e-=Ni(OH)2
D. 负极质量每减少6.5g,溶液质量增加6.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、根据如图回答下列问题。
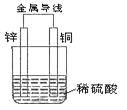
(1)该原电池外电路中电流方向:锌_______铜(填“→”或“←”)。
(2)该原电池中_______电极(写出电极材料名称)产生无色气泡, 写出该电极反应式:_______;该电极发生 _______反应(填“氧化”或“还原”)。 当电路中通过 0.2mol 电子时,该电极上产生的气体在标准状况下的体积为_____L。
(3)一段时间后,烧杯中溶液的 pH______(填“增大”或“减小”)。
II、美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示:两个 电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
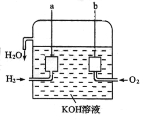
(1)a 极是_____,电极反应式是_____。
(2)b 极是_____,电极反应式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molNa2O2固体中含离子总数是3NA
B.0.1molMg 2+含有的核外电子数为0.2NA
C.常温下,1 L pH=13 的Ba(OH )2溶液中所含 OH-数目为 0.2NA
D.6.4 g Cu与足量硫充分反应,转移电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com