
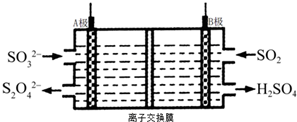
| A. | A电极接电源的正极 | |
| B. | A极区溶液的碱性逐渐增强 | |
| C. | 本装置中使用的是阴离子交换膜 | |
| D. | B极的电极反应式为SO2+2e-+2H2O═SO42-+4H+ |
分析 依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2-2e-+2H2O═SO42-+4H+,阳极与电源的正极B相连,A为电源负极,阴极发生还原反应由HSO3-生成S2O42-,以此解答该题.
解答 解:A.由HSO3-生成S2O42-,发生还原反应,A应为负极,故A错误;
B.阴极的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O,碱性增强,故B正确;
C.阳极的电极反应式为:SO2+2H2O-2e-═SO42-+4H+,阴极的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O,离子交换膜应使H+移动,应为阳离子交换膜,故C错误;
D.B为阳极,发生SO2+2H2O-2e-═SO42-+4H+,故D错误.
故选B.
点评 本题考查了电解池原理,为高频考点,侧重于学生的分析能力的考查,能正确判断电池的类型及两极的反应是解本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 时间/min 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
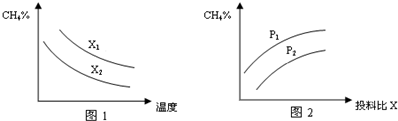
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 | |
| C. | 漂白粉有效成分是CaCl2和Ca(ClO)2,应密闭保存 | |
| D. | Cl2与水反应生成盐酸和次氯酸的离子方程式为:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏操作时,温度计的水银球要插入溶液中 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用分液漏斗分离水和四氯化碳时,水从上口倒出,四氯化碳从下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HC的电离度最大 | |
| B. | HA溶液酸性最强 | |
| C. | HC溶液酸性最强 | |
| D. | 三种溶液中酸的电离程度:HA<HB<HC |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溴的煤油溶液里加入苯震荡 | B. | 向溴水里加入酒精后震荡 | ||
| C. | 向碘的四氯化碳的溶液里加水震荡 | D. | 向碘水里加入四氯化碳后震荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 溶液体积(mL) | 反应后溶液的pH | |
| HA | KOH | ||
| ① | 10 | 10 | |
| ② | 10 | a | 7 |
| A. | 实验①所得的混合溶液中:c(K+)>c(A-)>c(H+)>c(OH-) | |
| B. | 实验①所得的混合溶液中:c(OH-)+c(A-)=c(K+)+c(H+) | |
| C. | 实验②所得的混合溶液中:c(A-)+c(HA)=0.1mol•L-1 | |
| D. | 实验②所得的混合溶液中:(K+)>c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,萃取剂的密度不一定比水大 | |
| B. | 检验溶液中是否有SO42-时,加入BaCl2溶液,再加稀硝酸,观察沉淀是否消失 | |
| C. | 以酚酞为指示剂向盐酸中滴加氢氧化钠溶液时,滴定终点时溶液由粉红色恰好变为无色 | |
| D. | 酸式滴定管、碱式滴定管、移液管都是准确量取一定体积液体的容器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com