
| A、Fe2+→Fe3+ |
| B、S2-→H2S |
| C、MnO4-→Mn2+ |
| D、AlO2-→Al3+ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、1:3 |
| C、1:4 | D、1:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
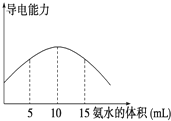 电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )| A、0.5% | B、1.5% |
| C、0.1% | D、1% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+和SO42- |
| B、Cu2+和Cl- |
| C、K+和SO42- |
| D、Ag+和NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子晶体中一定不含离子键,但一定存在共价键 |
| B、金属与非金属元素形成的化合物一定是离子化合物 |
| C、NCl3分子中所有的原子均为8电子稳定结构 |
| D、NaHSO4晶体中阴、阳离子的个数比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是用来衡量微观粒子多少的一种物理量 |
| B、在一定的温度和压强下,各种气体的摩尔体积相等 |
| C、阿伏加德罗常数的数值是0.012 kg碳所含的原子个数 |
| D、若气体摩尔体积为22.4 L?mol-1,则所处条件为标准状况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com