
| A、离子半径:O2->Na+>Mg2+ |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、热稳定性:HCl>PH3>H2S |
| D、结合氢离子能力:CO32->HCO3->SO42- |


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加稀硝酸,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液一定含有CO32- |
| D | 向某溶液中加入NaOH溶液并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体 | 该溶液中一定含有NH4+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
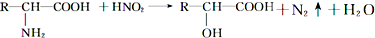 且已知:D、E的相对分子质量分别为162和144,可发生如下物质转化关系,如图所示:
且已知:D、E的相对分子质量分别为162和144,可发生如下物质转化关系,如图所示: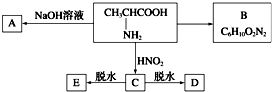
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、K+不一定存在 |
| B、K+、NH4+、CO32-、SO42- 一定存在 |
| C、Cl-一定存在 |
| D、Cl-、Mg2+、Ba2+一定不存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的密度不再发生变化 |
| B、反应过程中v(N2):v(H2)=1:3 |
| C、反应过程中c(N2):c(H2):c(NH3)=1:3:2 |
| D、单位时间内断开a mol H-H键的同时断开2a mol N-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、φ1>φ2 |
| B、n1>n2 |
| C、n1=n2 |
| D、φ1<φ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.5 | 2.00 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com