
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������������ˮ��pH��5.0��6.0��ͨ���������Fe(OH)3������Fe(OH)3�������ԣ�������������������������о���ˮ�����á��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ�����㣬�����˸�ѡ���������á�ij����С���õ縡ѡ���۷�������ˮ����Ƶ�װ��ʾ��ͼ��ͼ1��ʾ��
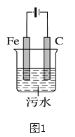
�ش��������⣺
��1���������У����������ĵ缫��ӦʽΪ______�����Ƶ�������ʹ��������ͬʱ���������缫��Ӧ������һ��Ϊ2H2O -4e�� === O2��+ 4H+����һ���缫��ӦʽΪ______��
��2��������Һ�еõ�Fe(OH)3���������ӷ���ʽΪ______��
��3��ij������ȼ�ϵ�������ڵĶ��ּ����̼���λ����Ϊ����ʣ�CH4Ϊȼ�ϣ�����Ϊ��������ϡ����������Ϊ�缫����ͼ2������������ȼ�ϵ��Ϊ�縡ѡ���۷��ĵ���Դ����
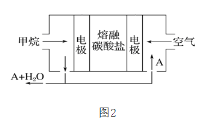
�������ĵ缫��ӦʽΪ______��
��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ���Ϊ�˵�ع���ʱ�����в���A���ʲμ�ѭ������A���ʵĻ�ѧʽ��______��
��ʵ������У���������������44.8L����״�������壬��������ȼ�ϵ������������CH4______L����״������
���𰸡�2H+ - 2e- === H2�� Fe-2e- ===Fe2+ 4Fe2+ + 10H2O + O2 === 4Fe(OH)3�� + 8H+ O2 + 2CO2 + 4e- ===2CO32-����2O2 + 4CO2 + 8e- === 4CO32-�� CO2 11.2
��������
��1����װ��ʾ��ͼ��֪��C�缫���Դ����������Ϊ���ص�������Fe�缫���Դ����������Ϊ���ص�������
��2������Feʧ���ӷ���������Ӧ����Fe2+��pH��5.0��6.0ʱ��Fe2+�ܱ�������������Fe��OH��3���ɫ������
��3��ȼ�ϵ���У����������ķ�Ӧ�������õ��ӱ���ԭ�Ĺ��̣����������ķ�Ӧ��ȼ��ʧ���ӱ������Ĺ��̣������������̼����Ϊ����ʣ�����ѭ�����õ�����ֻ�ж�����̼��
��1���ɵ縡ѡ���۷�������ˮ��װ��ʾ��ͼ��֪��C�缫���Դ����������Ϊ���ص��������������������ϵõ����ӷ�����ԭ��Ӧ�����������缫��ӦʽΪ2H+ - 2e- =H2����Fe�缫���Դ����������Ϊ���ص����������Ե缫Feʧ���ӷ���������Ӧ����Fe2+���缫��ӦʽΪFe-2e- =Fe2+��ͬʱˮ��������ʧ���ӷ���������Ӧ�����������缫��ӦʽΪ2H2O -4e�� =O2��+ 4H+���ʴ�Ϊ��2H+ - 2e- =H2����Fe-2e- =Fe2+��
��2������Feʧ���ӷ���������Ӧ����Fe2+��pH��5.0��6.0ʱ��Fe2+�ܱ�������������Fe(OH)3���ɫ��������Ӧ�����ӷ���ʽ�ɱ�ʾΪ4Fe2++10H2O+O2��4Fe(OH)3��+8H+���ʴ�Ϊ��4Fe2++10H2O+O2��4Fe(OH)3��+8H+��
��3����ȼ�ϵ�ع���ʱ��������̼�����������������ϵõ��ӷ�����ԭ��Ӧ����CO32-���缫��ӦʽΪO2 +2CO2 +4e- =2CO32-���ʴ�Ϊ��O2 +2CO2 +4e- =2CO32-��
��ȼ�ϵ�ع���ʱ��������̼�����м����ڸ�����ʧ���ӷ���������Ӧ����CO2���缫��ӦʽΪCH4+4CO32--8e-=5CO2+2H2O���ɸ�����Ӧʽ��֪��AΪCO2���ʴ�Ϊ��CO2��
��ʵ������У���������������ΪH2����״����44.8L H2�����ʵ���Ϊ2mol���ɵ�ʧ������Ŀ�غ��֪��������ȼ�ϵ������������CH4�����ʵ���Ϊ![]() =0.5mol����״����CH4�����Ϊ0.5mol��22.4L/mol=11.2L���ʴ�Ϊ��11.2��
=0.5mol����״����CH4�����Ϊ0.5mol��22.4L/mol=11.2L���ʴ�Ϊ��11.2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û���̿��ԭ�����Դ����������ij�о�С����2L�ܱ������м���һ�����Ļ���̿��NO��������ӦC(s)��2NO(g) ![]() N2(g)��CO2(g) ��H��0����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ��(mol/L)�����ʾ��������˵������ȷ����
N2(g)��CO2(g) ��H��0����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ��(mol/L)�����ʾ��������˵������ȷ����
ʱ��/t(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
A. 10~20 min�ڣ�NO��ƽ����Ӧ����Ϊ0.018mol/��Lmin��
B. T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=0.25
C. ������ǰ30min�ķ�Ӧ������ͬ�����������м���2molN2��2molNO����ƽ�������ƶ�
D. 30min��ֻ�ı���һ���������������������жϣ�����������Ϊ��С�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ�û��������ʵ�飬���ܴﵽĿ�ĵ��ǣ� ��
|
|
|
���ڹ����� |
A.��ϡ������Cu��Ӧ��ȡNO | B.��֤������ԭ��Ӧ���е���ת�� | C.������Ȫʵ�� | D.��֤����������ܷ�����Ӧ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ����Ҫ�Ļ����л�����ԭ�ϡ���ҵ�����ұ�����������ȡ����ϩ��
![]() (g)
(g)![]() (g)+H2(g) H=117.6kJ/mol
(g)+H2(g) H=117.6kJ/mol
��֪��������Ӧ�����ʷ���Ϊv��=k��P�ұ���v��=k��P����ϩP����������k����k���ֱ�Ϊ�����淴Ӧ���ʳ�����PΪ����ַ�ѹ��
(1)ͬʱ�����ұ��ķ�Ӧ���ʺ�ƽ��ת��������ȡ�Ĵ�ʩ��_______________��
(2)��CO2�����£��ұ��ɴ������Ʊ���ϩ�������ͬʱ������ͼ����;����
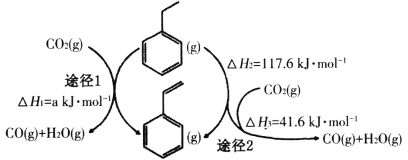
a=______�����ˮ����������ȣ��ù����л��ܹ�������Ӧ��CO2+H2=CO+H2O��CO2+C=2CO���¹��յ��ص���__________(�����)��
a.CO2��H2��Ӧ��ʹ�ұ����ⷴӦ�Ļ�ѧƽ������
b.���ø���ˮ�������ɽ�����������
c.�����ڼ������������п��ܲ����Ļ�̿
d.CO2�ڷ�Ӧ��ϵ��������
(3)��ʵ�������У�����Ӧ����ͬʱͨ���ұ���ˮ����������ˮ����ϡ�ͼ�������ұ�ת���ʵ�ԭ����_______________�����������ѹ(P��)���ұ�ת��������ʱ��仯�����ͼ��ʾ��ƽ��ʱ��P(H2O)=_______kPa��ƽ�ⳣ��Kp=____kPa(��ƽ���ѹ����ƽ��Ũ�ȼ���)��a����![]() =_________��
=_________��
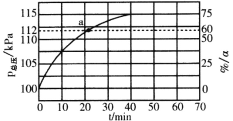
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��BHT��һ�ֳ��õ�ʳƷ�����������ɶԼ����ӣ�![]() ���ϳ�BHT�ij��÷�����2�֣���ͼ��������˵���У�����ȷ����
���ϳ�BHT�ij��÷�����2�֣���ͼ��������˵���У�����ȷ����
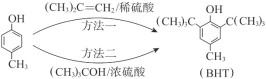
A. BHT��ʹ����KMnO4��Һ��ɫ
B. BHT��Լ����ӻ�Ϊͬϵ��
C. BHT��FeCl3��Һ��������ɫ��Ӧ
D. ����һ��ԭ�������ʸ��ڷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮFeCl2�dz��û�ԭ����ʵ�����п������÷�Ӧ2FeCl3+C6H5Cl![]() 2 FeCl2+ C6H4Cl2+HCl����ȡ����֪��C6H5Cl�۵�-45�����е�132����C6H4Cl2�۵�53�����е�173��������˵������ȷ���ǣ� ��
2 FeCl2+ C6H4Cl2+HCl����ȡ����֪��C6H5Cl�۵�-45�����е�132����C6H4Cl2�۵�53�����е�173��������˵������ȷ���ǣ� ��
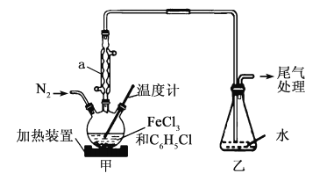
A.����a������������������������
B.��Ӧ��ʼǰӦ�����ͨN2��Ϊ��ֹFeCl2��װ���п�������
C.��Ӧ��|���л���ᆳ��ȴ�����ˡ�����õ������IJ�Ʒ
D.�������ԡ����������ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��װ��(��)��һ�ֿɳ���ص�ʾ��ͼ��װ��(��)Ϊ���ص�ʾ��ͼ��װ��(��)�����ӽ���Ĥֻ����![]() ͨ������طŵ�Ļ�ѧ����ʽΪ
ͨ������طŵ�Ļ�ѧ����ʽΪ![]() �����պ�Kʱ��X��������Һ�ȱ��ɫ������˵����ȷ���ǣ� ��
�����պ�Kʱ��X��������Һ�ȱ��ɫ������˵����ȷ���ǣ� ��
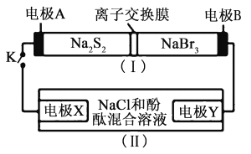
A.װ��(��)��AΪ����
B.�缫X�ĵ缫��Һ����ԭ��![]()
C.�ŵ�ʱ���缫B�ĵ缫��ӦʽΪ![]()
D.��ԭ��س��ʱ![]() ��������ͨ�����ӽ���Ĥ
��������ͨ�����ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йؾ������������ȷ���ǣ� ��
A����SiO2�����У���Si��O���ɵ���С��Ԫ���й���8��ԭ��
B����28g������У���Si��Si���ۼ�����Ϊ4NA
C�����ʯ���۷е���ھ���裬����ΪC��C������С��Si��Si��
D��þ�ͺ�ͭ�ͽ����������λ����Ϊ12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��װ���У���ƿ�г�����������a�����ι��е�Һ��b������ƿ�ڣ���������ƿ��Ȼ����ɼ�f���ձ��е�Һ��d����Ȫ״��������ռ���������ƿ����a��b�ֱ���(����)
ѡ�� | a(��������) | b(Һ��) |
|
A | NO2 | ˮ | |
B | CO2 | ����NaHCO3��Һ | |
C | Cl2 | ����NaCl��Һ | |
D | NH3 | 1 mol��L��1���� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com