
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、原子序数:A<B |
| B、A和B可能在同一主族 |
| C、A可能在第2周期ⅣA族 |
| D、A肯定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 起始浓度(mol?L-1) 物质 | 甲 | 乙 | 丙 |
| A | 0.03 | 0.06 | 0.04 |
| B | 0.01 | 0.02 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
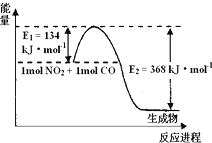 氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后的溶液中不含Fe2+ |
| B、放出的NO气体的体积在标准状况为2.24L |
| C、稀硝酸的物质的量浓度为0.2mol?L-1 |
| D、所得溶液中Fe2+和Fe3+的物质的量之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③ | C、①③ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com