
分析 (1)①氢氧化钠溶液中的氢离子是水电离的,据此计算出pH=11的氢氧化钠溶液中水电离的氢氧根离子;
②碳酸钠溶液中,碳酸根离子水解促进了水的电离,碳酸钠溶液中氢氧根离子是水电离的;
③水的电离平衡影响因素分析,酸碱抑制水的电离,水解的盐促进水的电离;
(2)加水稀释后,氢氧化钠为强电解质,氢氧根离子浓度变为原先的$\frac{1}{100}$,而碳酸钠溶液中碳酸根离子的水解程度增大,氢氧根离子浓度变化较小;
(3)纯碱溶液碱性是因为碳酸根离子水解;
(4)用酚酞和氯化钡溶液设计实验方案检验.
解答 解:(1)pH=11,溶液中c(OH-)=1.0×10-3mol/L,
①氢氧化钠溶液中,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,则氢氧化钠溶液中水电离的氢氧根离子浓度为:1.0×10-11mol/L,
故答案为:1.0×10-11mol/L;
②碳酸钠溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,则水电离的氢氧根离子浓度为:c(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-11}}$mol/L=1.0×10-3mol/L,
故答案为:1.0×10-3mol/L;
③水的电离平衡影响因素分析,酸碱抑制水的电离,水解的盐促进水的电离,在1L水中加入上述溶液中的氢氧化钠溶液会使水的电离程度减小,
故答案为:NaOH溶液;
(2)氢氧化钠为强电解质,溶液中完全电离,碳酸根离子的是水解为可逆反应,则溶液稀释后,氢氧化钠溶液的pH变化较大,碳酸钠溶液的pH变化较小,
故答案为:NaOH;
(3)纯碱溶液碱性是因为碳酸根离子水解;离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(4)探究纯碱溶液呈碱性是由CO32-引起的方法为:向纯碱溶液中滴入酚酞溶液,溶液显红色,若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去;这可以说明纯碱溶液呈碱性是由CO32-引起的,
故答案为:向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去;这可以说明纯碱溶液呈碱性是由CO32-引起的.
点评 本题考查了酸碱混合的定性判断、溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确水的电离及其影响因素,明确酸碱溶液抑制了水的电离、能够水解的盐溶液促进了水的电离.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:多选题
| A. | pH=4的醋酸中:c(H+)=1.0×10-4 mol•L-1 | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,溶液pH增大 | B. | 通入CO2,平衡朝正反应方向移动 | ||
| C. | 升高温度,$\frac{{c(HC{O_3}^-)}}{{c(C{O_3}^{2-})}}$减小 | D. | 加入NaOH固体,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空:
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 用途 | 解释 | |
| A | 氨常用作制冷剂 | 液氨汽化时要吸收大量的热,使周围温度降低 |
| B | SO2 可用于漂白纸浆 | SO2 具有氧化性 |
| C | 明矾可用于净水 | 明矾在水中生成的氢氧化铝胶状物质,有吸附性 |
| D | 常温下,可用铁、铝制容器盛装浓硝酸 | 铁、铝表面被氧化成的致密氧化物薄膜,阻止了酸与内层金属的进一步反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
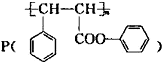 是一种环保型的新涂料,其合成路线如图所示:请回答下列问题:
是一种环保型的新涂料,其合成路线如图所示:请回答下列问题: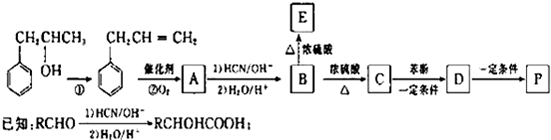
 .
. .
. .
.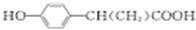 (写出其中一种的结构简式).
(写出其中一种的结构简式).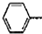 CH2CH=CH2合成B的另一种途径为:
CH2CH=CH2合成B的另一种途径为: CH2CH=CH2$\stackrel{Cl_{2}+CCl_{4}}{→}$F$→_{△}^{NaOH溶液}$H$\stackrel{氧化}{→}$
CH2CH=CH2$\stackrel{Cl_{2}+CCl_{4}}{→}$F$→_{△}^{NaOH溶液}$H$\stackrel{氧化}{→}$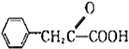 $→_{一定条件}^{G}$
$→_{一定条件}^{G}$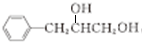 ,试剂G的化学式H2.
,试剂G的化学式H2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

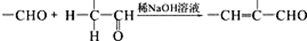 ;
; 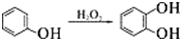
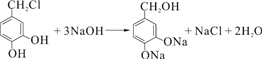 .
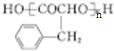
.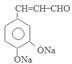 +2Ag(NH3)2OH$\stackrel{水浴}{→}$
+2Ag(NH3)2OH$\stackrel{水浴}{→}$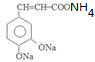 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. (任三种).
(任三种).查看答案和解析>>
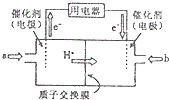
科目:高中化学 来源: 题型:选择题
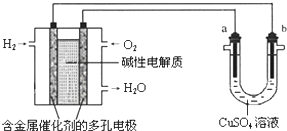
| A. | 燃料电池工作时,负极反应为:H2-2e-=2H+ | |
| B. | 若要实现铁上镀铜,则a极是铁,b极是铜 | |
| C. | 若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极均是石墨时,在相同条件下当电池中消耗H2 22.4 L(标准状况)时,a极析出铜64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c>b>d>a | B. | b>a>d>c | C. | a>d>b>c | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com