
 .
.分析 l~36号的四种元素A、B、C、D,其原子序数依次增大且属于不同周期,自然界中存在多种A的化合物,则A为H元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为C元素;D的基态原子的最外能层只有一个电子,其他能层均已充满电子,D原子外围电子排布为3d104s1,则D为Cu元素,结合原子序数可知,C只能处于第三周期,B与C可形成正四面体型分子,则B为Cl元素,据此进行解答.
解答 解:l~36号的四种元素A、B、C、D,其原子序数依次增大且属于不同周期,自然界中存在多种A的化合物,则A为H元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为C元素;D的基态原子的最外能层只有一个电子,其他能层均已充满电子,D原子外围电子排布为3d104s1,则D为Cu元素,结合原子序数可知,C只能处于第三周期,B与C可形成正四面体型分子,则B为Cl元素,
(1)四种元素中电负性最大的是Cl,其基态原子的价电子排布为3s23p5,其基态原子的价电子排布图为 ,
,
故答案为: ;
;
(2)HF分子之间形成氢键,使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高,即沸点由高到低的顺序是HF>HI>HBr>HCl,
故答案为:HF>HI>HBr>HCl;HF分子之间形成氢键,使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高;
(3)Cu为29号元素,原子核外有29个电子,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(5)硫酸铜溶液中加入氨水会产生蓝色沉淀,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,得到四氨合铜络离子,沉淀溶解离子方程式为:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-.
点评 本题考查位置结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
 常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )| A. | HR为强电解质 | |
| B. | 图中四点,水的电离程度:c>b>d>a | |
| C. | 若常温时,0.1mol/LHR溶液的电离度为1%,则常温时R+的水解常数约为10-9 | |
| D. | b点溶液中存在c(Na+)=c(R+)+c(HR) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9mol/L | B. | 1.8mol/L | C. | 2.1mol/L | D. | 1.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. +
+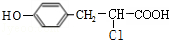 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com