
【题目】向10 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(Al3+)
B.x=20时,溶液中所发生反应的离子方程式为Al3++2SO42-+2Ba2++4OH-=AlO2-+2H2O+2BaSO4↓
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.滴加过程中,生成沉淀的最大物质的量为0.003 mol
【答案】D
【解析】
滴入Ba(OH)2溶液,Ba2+与SO42-反应生成BaSO4沉淀,然后反应的先后顺序是Al3+、NH4+、Al(OH)3,据此分析;
A、当加入10mLBa(OH)2溶液,有1×10-3molBa2+与1×10-3molSO42-反应,SO42-有剩余,OH-先与Al3+反应:Al3++3OH-=Al(OH)3↓,OH-的量不足,2×10-3molOH-消耗![]() mol的Al3+,Al3+有剩余,NH4+不参与反应,因此溶液中含有的离子是NH4+、Al3+、SO42-,溶液中c(NH4+)>c(Al3+),故A错误;
mol的Al3+,Al3+有剩余,NH4+不参与反应,因此溶液中含有的离子是NH4+、Al3+、SO42-,溶液中c(NH4+)>c(Al3+),故A错误;
B、x=20mL时,Ba2+与SO42-恰好完全反应,Al3+与OH-反应生成OH-,多余的OH-全部与NH4+反应生成NH3·H2O,离子反应方程式为NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O,故B错误;
C、当x=30mL时,10mL0.1mol·L-1NH4Al(SO4)2溶液中含有0.001molNH4+、0.001molAl3+、0.002molSO42-,30mL等浓度的Ba(OH)2溶液0.003molBa2+、0.006molOH-,混合后生成BaSO4沉淀,剩余0.001molBa2+,OH-过量溶液中存在0.001molAlO2-,OH-剩余0.001mol,因此溶液有Ba2+、AlO2-、OH-,且c(OH-)>c(AlO2-),故C错误;
D、滴加过程中,生成沉淀的最大物质的量为Al(OH)3、BaSO4,当NH4Al(SO4)2溶液和Ba(OH)2溶液按照物质的量之比为1:2混合,沉淀的量最大为0.002molBaSO4和0.001mol的Al(OH)3,即沉淀的最大量为0.003mol,故D正确;
答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 稀醋酸中加入少量醋酸钠固体能降低醋酸的电离程度
B. 25 ℃时,硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C. CaCO3的水溶液导电性很弱,但CaCO3是强电解质
D. 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)800℃时,某密闭容器中存在如下反应:2NO2(g) ![]() 2NO(g) + O2(g) △H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的浓度随时间的变化如图曲线I所示
2NO(g) + O2(g) △H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的浓度随时间的变化如图曲线I所示
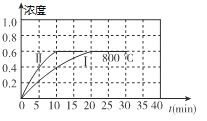
①反应Ⅱ相对于反应I而言,改变的条件可能是_______________.
②800℃时,若开始时向容器中同时加入1mol/LNO、0.2mol/LO2、0.5mol/L NO2,则v正____________v逆(填“<”、“>”或“=”)
(2)己知N2O4(g) ![]() 2NO2(g) △H=+57.20kJ/mol,t min时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) △H=+57.20kJ/mol,t min时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
①c(X)代表__________(填化学式)的浓度,该反应的平衡常数K=_____________。
②前10min内用NO2浓度变化表示的反应速率为___________,20min时改变的条件是_____________;重新达到平衡时,NO2的质量分数___________________。
a.增大 b.减小
c.不变 d.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
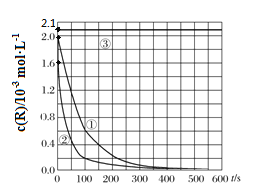
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)CH2=CH C(CH3) =CH2系统命名为:____________________________。
(2)除去乙烷中少量的乙烯:____________________________。
(3)写出“间甲基苯乙烯”的结构简式 :____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A+2BC+3D 各物质均为气体在不同情况下测得有下列 4 种反应速率, 其中反应最快的是
A.v(A)=0.45mol·(L·s)![]() B.v(B)=0.6mol·(L·s)
B.v(B)=0.6mol·(L·s)![]()
C.v(C)=0.5mol·(L·s)![]() D.v(D)=0.4mol·(L·s)
D.v(D)=0.4mol·(L·s)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油的催化重整可以得到芳香烃,说明石油中含有芳香烃
B. 煤的干馏和石油裂解得到的产物相同
C. 石油分馏得到的产物可用来萃取溴水中的溴
D. 聚丙烯塑料的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) △ H﹥0,在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g) △ H﹥0,在一容积可变的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率__________(填“增大”“不变”或“减小”,下同),平衡__________移动(填“不”“向正反应方向”或“向逆反应方向”,下同)。
(2)将容器的体积缩小一半,其正反应速率__________,平衡__________移动。
(3)升高温度,其正反应速率__________,平衡__________移动。
(4)保持体积不变,充入水蒸气,其正反应速率________,平衡________移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠进行多角度探究:
Ⅰ.亚硝酸钠的制备。

(1)装置B的作用是___________________________________________。
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为______________。
Ⅱ.探究亚硝酸钠与硫酸反应的气体产物成分。
已知:①NO+NO2+2OH-=2NO+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃
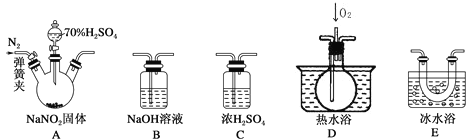
(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是_______________________。
(4)仪器的连接顺序(按左→右连接):A→C→________。
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,装置A中产生红棕色气体。
①确认装置A中产生的气体含有NO,依据的现象是_______________________。
②若D中通入过量O2,装置B中的化学方程式是_______________________。
Ⅲ.设计实验证明酸性条件下NaNO2具有氧化性。
(6)供选用的试剂:NaNO2溶液、KMnO4溶液、Fe2(SO4)3溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com