
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: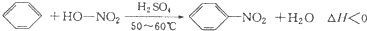
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
分析 (1)装置B为分液漏斗,装置C为球形冷凝管,起冷凝回流作用;
(2)配制混酸应防止液体迸溅;
(3)反应在50℃~60℃下进行,利用水浴加热控制;
(4)用氢氧化钠洗去溶解少量酸,水洗除去未反应的NaOH及生成的盐;
(5)直形冷凝管通常需要通入冷凝水,温差过大容易发生炸裂;
(6)根据苯的质量计算硝基苯的理论产量,产量=(实际产量÷理论产量)×100%.
解答 解:(1)由仪器结构特征可知,装置B为分液漏斗,装置C为球形冷凝管,苯与浓硝酸都以挥发,C起冷凝回流作用,提高原料利用率,
故答案为:分液漏斗;冷凝回流;
(2)浓硝酸与浓硫酸混合会放出大量的热,如将浓硝酸加入浓硫酸中,硝酸的密度小于浓硫酸,可能为导致液体迸溅,
故答案为:不能,容易发生迸溅;
(3)反应在50℃~60℃下进行,低于水的沸点,可以利用水浴加热控制,
故答案为:水浴加热;
(4)先用水洗除去浓硫酸、硝酸,再用氢氧化钠除去溶解的少量酸,最后水洗除去未反应的NaOH及生成的盐,
故答案为:洗去残留的NaOH及生成的盐;
(5)直形冷凝管通常需要通入冷凝水,以免直形冷凝管通水冷却时导致温差过大而发生炸裂,选用空气冷凝管,不选用直形冷凝管,
故答案为:以免直形冷凝管通水冷却时导致温差过大而发生炸裂;
(6)苯完全反应生成硝基苯的理论产量为15.84g×$\frac{123}{78}$,故硝基苯的产率为[18g÷(15.84g×$\frac{123}{78}$)]×100%=72%,
故答案为:72%.
点评 本题考查有机物制备实验,涉及对装置及操作的分析评价、物质的分离提纯、产率计算等,难度中等,注意操作规范性及仪器作用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X | 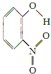 | 0.2 | 45 | 100 |
| Y | 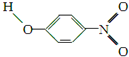 | 1.7 | 114 | 295 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单质铁与盐酸的反应 Fe+2 H+=Fe2++H2↑ | |
| B. | 氨水跟硫酸发生酸碱中和反应 OH-+H+=H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙加入醋酸溶液中 CaCO3+2CH3COOH=CO2↑+2CH3COO-+H2O+Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 冶炼原理 | 方法 | |
| A | 2HgO$\frac{\underline{\;加热\;}}{\;}$2Hg+O2↑ | 热分解法 |
| B | 2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | 电解法 |
| C | Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | 热分解法 |
| D | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | 热还原法 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O?NH+4+OH- | B. | KClO3=K++Cl-+3O2- | ||
| C. | H2CO3=2H++CO32- | D. | Ba(OH)2=Ba2++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com