
| A. | 滴加酚酞显无色溶液 | B. | 含有较多H+的溶液 | ||
| C. | pH<7的溶液 | D. | c(OH-)<c(H+)的溶液 |
分析 A.酚酞变色范围为8-10;
B.任何电解质水溶液中都含有氢离子;
C.pH<7的溶液可能呈酸性、中性或碱性;
D.任何电解质溶液中只要存在c(OH-)<c(H+),则该溶液一定呈酸性.
解答 解:A.酚酞变色范围为8-10,所以滴加酚酞显无色溶液可能呈酸性、中性或碱性,故A错误;
B.任何电解质水溶液中都含有氢离子,所以含有较多氢离子的溶液不一定呈酸性,也可能呈碱性,故B错误;
C.pH<7的溶液可能呈酸性、中性或碱性,如:95℃时纯水pH=6,该温度下pH<7的溶液可能呈酸性、中性或碱性,故C错误;
D.任何电解质溶液中只要存在c(OH-)<c(H+),则该溶液一定呈酸性,所以c(OH-)<c(H+)的溶液呈酸性,故D正确;
故选D.
点评 本题考查电解质溶液酸碱性判断,为高频考点,根据溶液中c(OH-)、c(H+)的相对大小确定溶液酸碱性,温度未知时不能根据溶液的pH判断溶液酸碱性,易错选项是AC.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Cu、Ag | B. | K、Al、Zn、Fe | C. | Na、Zn、Fe、Cu | D. | Cu、Ag、Fe、Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 硫酸工业生产中,使用过量空气以提高SO2的利用率 | |
| D. | 合成氨反应采用催化剂以提高氨气的生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用饱和NaCl溶液除去Cl2中的HCl | |
| B. | 乙酸乙酯在碱性条件下水解更充分 | |
| C. | 工业合成氨反应:N2(g)+3H2(g)?2NH3 (g)△H=-92.4kJ/mol,采用较高的温度下进行 | |
| D. | 接触法制硫酸工业中通入过量空气与SO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | CaCO3 | FeCl3 | H2SO4 | NaOH |
| 弱电解质 | HF | CH3COOH | BaSO4 | Na2S |
| 非电解质 | CH4 | Cu | H2O | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油分馏、裂化、裂解获得的产品都是混合物 | |
| B. | 石油分馏是化学变化,可得到汽油、煤油 | |
| C. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 | |
| D. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇和丙三醇 | B. | C6H5-OH和C6H5-CH2OH | ||
| C. | C2H4O和C4H8O | D. | C2H6和C10H22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
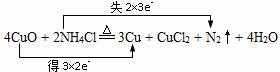 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com