
设NA为阿伏加德罗常数的值。下列叙述正确的是( )。
A.标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA
B.常温下,0.1 mol·L-1 NH4NO3溶液中NO3-数目为0.1NA
C.常温常压下,4.0 g CH4中含有共价键的数目为NA
D.标准状况下,22.4 L CHCl3含有分子的数目为NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高考化学题型冲刺练习 基础实验题(解析版) 题型:选择题
仅用下表提供的仪器和药品,就能达到相应实验目的的是( )
编号 | 仪器 | 药品 | 实验目的 |
A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量分数的NaCl溶液 |
B | 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 | 盐酸、大理石、碳酸钠溶液 | 证明非金属性:Cl>C>Si |
C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
D | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液、NaOH溶液 | 提纯混有MgCl2杂质的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版专练3限定条件离子共存及离子方程式书写练习卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是( )。
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.向澄清石灰水中通入少量CO2:OH-+CO2=HCO3-
D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练4 无机化工流程题专项突破练习卷(解析版) 题型:填空题
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
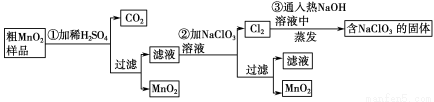
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是 +
+ ClO3-+
ClO3-+ =
= MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列说法正确的是( )。
A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1 NA
B.常温常压下,18 gH2O中含有的原子总数为3 NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5 NA
D.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法中正确的是( )。
A.等物质的量的CO2和NH3中所含的分子数均为NA
B.标准状况下,33.6 L SO3中含有的氧原子数是4.5NA
C.常温下,34.5 g NO2与N2O4的混合物中含有1.5NA个氧原子
D.电解精炼铜时,每转移2NA个电子,阳极溶解64 g铜
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练1 化学实验仪器的创新使用练习卷(解析版) 题型:填空题
某兴趣小组的同学共同设计了如图所示的多功能实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
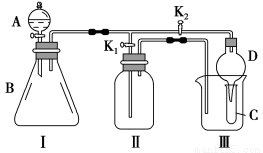
(1)现有以下药品:锌粒、铜片、浓H2SO4、浓HNO3、蒸馏水、NaOH溶液。打开K1,关闭K2,可制取 气体。
(2)某同学用石灰石、醋酸、硅酸钠溶液等药品设计了另一实验。他的实验目的是 ;打开K2,关闭K1,将A中液体加入B中后,观察到的实验现象为 。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
已知酸H2B在水溶液中存在下列关系:①H2B H++HB- ②HB-
H++HB- ②HB- H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
A.NaHB属于弱电解质
B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-]
C.[Na+]=[HB-]+[B2-]+[H2B]
D.NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 实验操作 | 现 象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com