【答案】
分析:R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1,及p能级只有1个电子,R原子核外电子排布为1s
22s
22p
1,故R为硼元素;Y元素原子的3p能级处于半充满状态,Y原子的核外电子排布为1s
22s
22p
63s
23p
3,故Y为磷元素;W的氢化物的沸点比同族其它元素氢化物的沸点高,考虑氢键的存在,且X
2+与W
2-具有相同的电子层结构,故X处于第三周期、W处于第二周期,故X为Mg元素、W为氧元素;Z
+的电子层都充满电子,各层电子数为2、8、18,故Z原子核外电子数为2+8+18+1=29,故Z为Cu元素,据此解答.
解答:解:R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1,及p能级只有1个电子,R原子核外电子排布为1s
22s
22p
1,故R为硼元素;Y元素原子的3p能级处于半充满状态,Y原子的核外电子排布为1s
22s
22p
63s
23p
3,故Y为磷元素;W的氢化物的沸点比同族其它元素氢化物的沸点高,考虑氢键的存在,且X
2+与W
2-具有相同的电子层结构,故X处于第三周期、W处于第二周期,故X为Mg元素、W为氧元素;Z
+的电子层都充满电子,各层电子数为2、8、18,故Z原子核外电子数为2+8+18+1=29,故Z为Cu元素,
(1)Z为Cu元素,原子核外电子数为29,原子核外电子排布式为1s
22s
22p
63s
23p
63d
104s
1,Cu的基态原子的外围电子排布式为3d
104s
1,
故答案为:3d
104s
1;
(2)H原子成1个键,O原子成2个键,B原子一般是形成3个键,B形成4个键,其中1个键很可能就是配位键,则成3个键的B原子为SP
2杂化,成4个键的B为SP
3杂化;
观察模型,可知A
m-是(H
4B
4O
9)
m-,依据化合价H为+1,B为+3,O为-2,可得m=2,
故答案为:SP
2、SP
3;2;
(3)经X射线探明,Mg与O形成化合物的晶体结构与NaCl的晶体结构相似,Mg
2+的周围有6个O原子,为如图结构
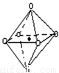
,故配位原子所构成的立体几何构型为正八面体,
故答案为:正八面体;
(4)A.[Z(NH
3)
4]SO
4中,内界离子[Cu(NH
3)
4]
2+与外界离子SO
42形成离子键,Cu
2+与NH
3形成配位键,NH
3中N原子与H原子之间形成极性键,故A正确;
D.在[Z(NH
3)
4]SO
4中Z
2+提供空轨道,NH
3给出孤对电子,故B错误;
C.[Z(NH
3)
4]SO
4组成元素中第一电离能最大的是N元素,故C错误;
D.SO
42-与PO
43-互为等电子体,价层电子总数相同,空间结构相同,SO
42-中S原子成4个σ键,孤对电子对数为
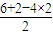
=0,价层电子对为4,为正四面体,故D正确
故答案为:AD;
(5)固体PCl
5的结构实际上是PCl
4+和PCl
6-构成的离子晶体,其晶体结构与CsCl相似,则晶胞的组成为P
2Cl
10,晶胞中相当于含有2个PCl
5,若晶胞边长为apm,则晶胞的密度为
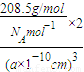
=
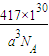
g?cm
-3,
故答案为:
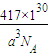
.
点评:本题考查核外电子排布规律、配合物、杂化轨道、晶胞结构与计算等,难度较大,(3)(5)为易错点、难点,需要学生识记常见晶体的晶胞结构.

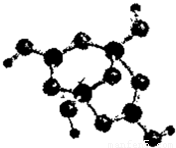
 ,故配位原子所构成的立体几何构型为正八面体,
,故配位原子所构成的立体几何构型为正八面体,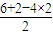 =0,价层电子对为4,为正四面体,故D正确
=0,价层电子对为4,为正四面体,故D正确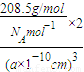 =
=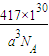 g?cm-3,
g?cm-3,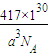 .
.

 名校课堂系列答案
名校课堂系列答案