
| 元素符号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径10-1nm | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5-3 | +7-1 | +1 | +5-3 | +3 |
| A. | 元素④的原子序数小于元素⑦的原子序数 | |
| B. | ②、③处于同一周期 | |
| C. | 上述八种元素中.最高价氧化物对应水化合物酸性最强的元素是⑤ | |
| D. | ⑧号元素原子结构示意图为: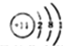 |
分析 ①只有最低价-2价,则①为O;⑤有+7、-1价,处于ⅦA族,为Cl元素;④⑦有+5、-3价,处于ⅤA族,且④原子半径较大,则④为P、⑦为N;③⑥只有最高正价+1价,处于ⅠA族,且⑥的原子半径较大,③原子半径不是最小,则③为Li、⑥为Na;②最高价+2价,处于ⅡA族,原子半径大于P,则②为Mg;⑧最高价为+3价,处于ⅢA族,原子半径小于P元素,则⑧为B元素,据此解答.
解答 解:①只有最低价-2价,则①为O;⑤有+7、-1价,处于ⅦA族,为Cl元素;④⑦有+5、-3价,处于ⅤA族,且④原子半径较大,则④为P、⑦为N;③⑥只有最高正价+1价,处于ⅠA族,且⑥的原子半径较大,③原子半径不是最小,则③为Li、⑥为Na;②最高价+2价,处于ⅡA族,原子半径大于P,则②为Mg;⑧最高价为+3价,处于ⅢA族,原子半径小于P元素,则⑧为B元素,
A.④为P、⑦为N,④的原子序数较大,故A错误;
B.②为Mg,处于第三周期,③为Li,处于第二周期,二者不处于同一周期,故B错误;
C.⑤Cl元素,其元素最高价氧化物对应的水化物为HClO4,是最强的无机含氧酸,故C正确;
D.⑧为B元素,原子结构示意图为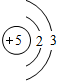 ,故D错误;故选C.
,故D错误;故选C.
点评 本题主要考查的是性质结构位置关系应用,根据化合价与原子半径推断元素是解题的关键,注意掌握元素周期律,难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
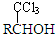 (-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾
(-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾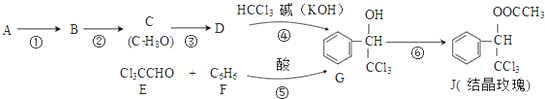
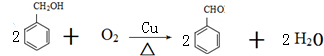 .
.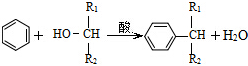 ,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.
,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.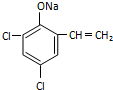 或
或 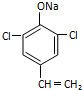 (只写一种).
(只写一种).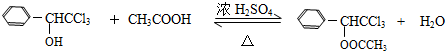 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
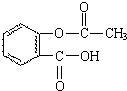 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离常数如表,则2NaF+H3PO4═2HF+Na2HPO4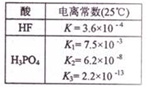 | |
| B. | 以金属铜为电极电解饱和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向0.1mol?L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| D. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| C. | 1L0.1mol•L-1的氨水中有0.1NA个N原子 | |
| D. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
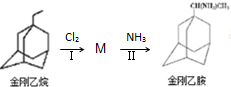
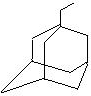 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
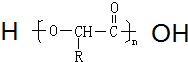 .
.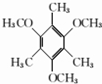 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com