
分析 (1)铁与水蒸气反应生成四氧化三铁和氢气;
(2)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(3)NaHCO3与少量Ca(OH)2溶液反应生成碳酸钙沉淀、碳酸钠和水.
解答 解:(1)铁与水蒸气在加热条件下能够反应生成四氧化三铁,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
(2)氧化铝为两性氧化物,能够与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)NaHCO3与少量Ca(OH)2溶液反应,氢氧化钙不足,反应生成碳酸钠、碳酸钙沉淀和水,反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O,
故答案为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O.
点评 本题考查了离子方程式的书写方法,题目难度不大,注意掌握离子方程式的书写原则,明确反应物过量情况对生成物的影响,如(3)为易错点,试题培养了学生的灵活应用能力.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
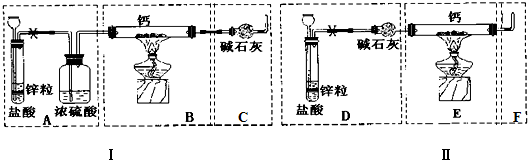
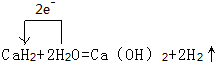 ,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象
,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是还原剂 | B. | C被氧化 | ||
| C. | SiO2发生氧化反应 | D. | O得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
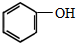 (制酚醛树脂)
(制酚醛树脂) 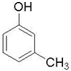 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )查看答案和解析>>
科目:高中化学 来源: 题型:解答题
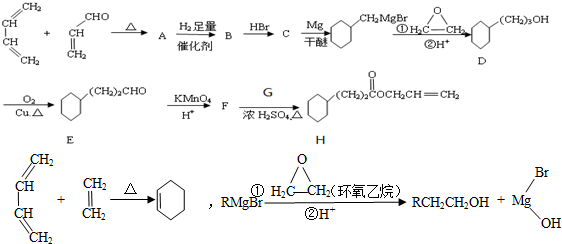
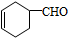 ,G物质核磁共振氢谱共有4个峰.
,G物质核磁共振氢谱共有4个峰. .写出D生成E的化学方程式
.写出D生成E的化学方程式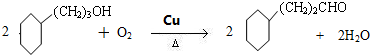 .
.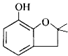 呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式:
呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式: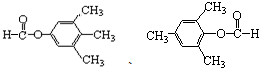 .
.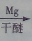 CH3CH2MgBr
CH3CH2MgBr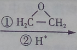 CH3CH2CH2CH2OH.
CH3CH2CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2CO3+H2SO4═(NH4)2SO4+H2O+CO2↑ | |
| B. | NaHCO3+HNO3═NaNO3+H2O+CO2↑ | |
| C. | Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑ | |
| D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com