
1��52gͭþ�Ͻ���ȫ�ܽ���50mL�ܶ�Ϊ1.40g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120mL����״��������Ӧ�����Һ�м���1.0mol/L NaOH��Һ������������ȫ������ʱ���õ�2.54g����������˵���в���ȷ���ǣ� ��
A��NO2��N2O4�Ļ�������У�NO2�����������80%
B����Ũ������HNO3�����ʵ���Ũ����14.0mol/L
C���úϽ���ͭ��þ�����ʵ���֮����2��1
D���õ�2.54g����ʱ������NaOH��Һ�������600mL

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�챱���и���12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯����ͼ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ķǽ�������ͬ����Ԫ������ǿ������˵����ȷ���ǣ� ��
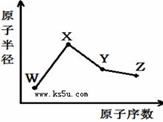
A. ����ϼ�X��Y��Z��W
B. ��̬�⻯����ȶ���Z��Y��W
C. Y����������X��Z������������Ӧ��ˮ������ܷ�Ӧ
D. X��Z��W����Ԫ���γɵĻ�����һ���Ⱥ����Ӽ��ֺ����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ɽ��ʡ�����и���12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
 ���б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ��
���б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ�� �ǣ�
�ǣ�
A����ϡHNO3�еμ�Na2SO3��Һ��SO32��+2H+=SO2��+H2O
B����Na2SiO3��Һ��ͨ�����SO2��SiO32��+SO2+H2O=H2SiO3��+SO32��
C����Al2(SO4)3��Һ�м��������NH3��H2O��Al3++4NH3��H2O=[Al(OH)4]��+4NH4+
D����CuSO4��Һ�м���Na2O2��2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2��+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ������ѧ�ڽο�����ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ���ǣ� ��
A������ϡ���ᷴӦ��2Fe+6H+�T2Fe3++3H2�� 
B��Cu�ӵ�ϡ�����У�Cu+2H+�TCu2++H2��
C��������NaOH��Һ��Ӧ��Cl2+OH-�TCl-+ClO-+H2O
D��̼����������Һ��Ӧ��CaCO3+2H+�TCa2+ +CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ������ѧ�ڽο�����ѧ�Ծ��������棩 ���ͣ�ѡ����
���л�ѧ������ﲻ��ȷ���� �� ��
A������ķ��ӽṹ���ģ��ʾ��ͼ��
B��PCl5�и�ԭ���������ܴﵽ8���ӵ��ȶ��ṹ
C��������̼�Ľṹʽ�� O=C=O
D��̼�����Ƶĵ��뷽��ʽ��NaHCO3= Na+ + HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���㽭ʡ�����и߶������л�ѧ�Ծ��������棩 ���ͣ�ʵ����
ij�о�С��Ϊ��̽��һ�ֿ���ҩX���������ֶ�����Ԫ�أ�����ɺ����ʣ���Ʋ����������ʵ�飺
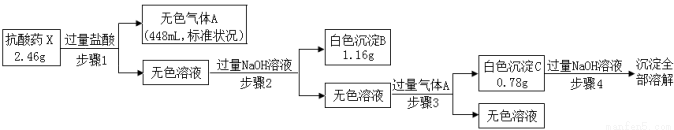
��ش��������⣺
��1����ɫ����B�Ļ�ѧʽ�� ��
��2������3�����ɳ���C�����ӷ���ʽΪ ��
��3��X�Ļ�ѧʽΪ ��
��4���ÿ���ҩ���ʺ�θ������֢����ʹ�ã�ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���㽭ʡ�����и߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ͭ��Ũ���ᷴӦ�õ�����ͭ��Һ��NO2��N2O4��NO ������壬��Щ������3.36LO2���������Ϻ�ͨ��ˮ�У���������ǡ����ȫ��ˮ�����������ᣬ������ͭ������Ϊ�� ��
A��6.4g B��9.6g C��19.2g D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���㽭ʡ��Ϫ�и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
��֪���������Ȼ�ѧ����ʽ��
H2��g����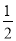 O2��g��=H2O��l�� ��H=-285 kJ/mol
O2��g��=H2O��l�� ��H=-285 kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ��H=-2220.0 kJ/mol
��1��ʵ����H2��C3H8�Ļ�����干3 mol��ȫȼ������Һ̬ˮʱ����2790 kJ������������H2��C3H8�������Ϊ____________��
��2����֪��H2O(l)=H2O(g) ��H=+44.0 kJ/mol��д������ȼ������CO2����̬ˮ���Ȼ�ѧ����ʽ��_____________________________��
(3)��H����Cu2����Na����SO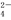 ��Cl������������ѡ���ʵ�������
��Cl������������ѡ���ʵ������� ��ɵ���ʣ���������Ҫ��
��ɵ���ʣ���������Ҫ��
����ʯī��Ϊ�缫�����ʱ�����������С��ˮ�����䣬Ӧѡ�õĵ������________��
����ʯī��Ϊ�缫�����ʱ������������䣬ˮ����С��Ӧѡ�õĵ������________��
����ʯī��Ϊ����������Ϊ���������ʱ�����������ˮ������С��Ӧѡ�õĵ������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�߶��ϰ��ڿ��Ի�ѧ���������棩 ���ͣ�ѡ����
�����£���Ũ��Ϊ 0.1 mol/L�����Ϊ V L �İ�ˮ����μ��� 0.1 mol/L �����ᣬ���� ��ѡ������ֵ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com