
【题目】(化学----选修5:有机化学基础)
![]() 是药物合成中的一种重要中间体,下面是
是药物合成中的一种重要中间体,下面是![]() 的一种合成路线:
的一种合成路线:

已知: 。
。
请回答下列问题:
(1)![]() 所含官能团的名称为___________;
所含官能团的名称为___________;![]() 的结构简式为_______________,
的结构简式为_______________,![]() 生成
生成![]() 的反应类型为_______________________。
的反应类型为_______________________。
(2)![]() 的名称是____________。
的名称是____________。
(3)由![]() 和
和![]() 合成
合成![]() 的化学方程式为______________________。
的化学方程式为______________________。
(4)![]() 的同分异构体中,能发生银镜反应且分子结构中含苯环的还有_______________种,其中核磁共振氢谱上有6组峰,峰面积之比为1:1:1:1:1:1的同分异构体的结构简式为__________(一种即可)。
的同分异构体中,能发生银镜反应且分子结构中含苯环的还有_______________种,其中核磁共振氢谱上有6组峰,峰面积之比为1:1:1:1:1:1的同分异构体的结构简式为__________(一种即可)。
(5)参照上述合成路线,以![]() 为原料(其他试剂任选),设计制备巴豆醛(
为原料(其他试剂任选),设计制备巴豆醛(![]() )的合成路线。________________________________________
)的合成路线。________________________________________
【答案】醛基、醚键  取代反应 对羟基苯甲醛
取代反应 对羟基苯甲醛  3
3 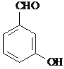 或
或
![]()
![]() CH3CH2OH
CH3CH2OH ![]() CH3CHO
CH3CHO ![]()
![]() 。
。
【解析】
通过比较反应物和生成物的结构,从化学键的断裂、形成角度分析题目中的信息,找出反应的规律,这是解答有机题的关键。
(1)![]() 中官能团有醛基、醚键。题中“已知”,在酚羟基邻位或对位引入乙酰基(CH3CO-),结合C结构可知,A→B引入1个乙酰基,则
中官能团有醛基、醚键。题中“已知”,在酚羟基邻位或对位引入乙酰基(CH3CO-),结合C结构可知,A→B引入1个乙酰基,则![]() 的结构简式为
的结构简式为 。
。![]() →
→![]() 是2个酚羟基氢原子被CH3I中的甲基所代替,反应类型为取代反应。
是2个酚羟基氢原子被CH3I中的甲基所代替,反应类型为取代反应。
(2)将![]() →
→![]() 的反应原理应用于D→
的反应原理应用于D→![]() ,则D为
,则D为![]() (对羟基苯甲醛)。
(对羟基苯甲醛)。
(3)![]() 和
和![]() 合成
合成![]() 时,C中羰基邻位上的甲基断裂2个氢原子,E中断裂醛基氧原子,生成F和1个水分子。化学方程式为
时,C中羰基邻位上的甲基断裂2个氢原子,E中断裂醛基氧原子,生成F和1个水分子。化学方程式为 。
。
(4)![]() 的同分异构体中,有醛基和苯环的还有3种:
的同分异构体中,有醛基和苯环的还有3种: 、
、 、
、 ,其中有6种氢原子,且数目之比为1:1:1:1:1:1是
,其中有6种氢原子,且数目之比为1:1:1:1:1:1是 或
或 。
。
(5)有机原料![]() 分子中只有2个碳原子,目标产物巴豆醛
分子中只有2个碳原子,目标产物巴豆醛![]() 分子中有4个碳原子,故需应用“
分子中有4个碳原子,故需应用“![]() +
+![]() →
→![]() +H2O”将两个CH3CHO分子“连接”成
+H2O”将两个CH3CHO分子“连接”成![]() 。
。![]() 经水解、氧化可生成CH3CHO。因此,合成路线为
经水解、氧化可生成CH3CHO。因此,合成路线为
![]()
![]() CH3CH2OH
CH3CH2OH ![]() CH3CHO
CH3CHO ![]()
![]() 。
。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】以氯酸钠等为原料制备亚氯酸钠的工艺流程如下,下列说法错误的是

A. NaClO3在发生器中作氧化剂
B. 吸收塔中1mol H2O2得到2mol电子
C. 吸收塔中温度不宜过高,会导致H2O2的分解
D. 从“母液”中可回收的主要物质是Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pBa=-lgc(Ba2+),pKa=-lgc(Ka)。已知常温下H2CO3:pKa1=6.4,pKa2=10.3。向20mL 0.1mol·L1 BaCl2溶液中滴加0.2mol·L1 Na2CO3溶液的滴定曲线如图所示。下列说法正确的是

A. E、F、G三点的Ksp从大到小的顺序为:G>F>E
B. 其他条件相同,用MgCl2溶液替代BaCl2溶液,F点向G点迁移
C. 常温下,Ksp(BaCO3)≈1.0×109
D. 常温下,Na2CO3溶液的pKh1=7.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

(1)密闭容器的体积是_____L;
(2)若t1=15时,则t0~t1 s内以C物质浓度变化表示的反应速率v(C)=_______;
(3)写出反应的化学方程式:________________________;
(4)t1 s时,A的转化率为__________,此时v(A)正______v(B)逆(选填“>”、“<”或“=”);
(5)B的起始的物质的量是_____;
(6)平衡时体系内的压强为初始状态的___________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某弱酸溶液中存在电离平衡HA![]() H++A-,下列叙述不正确的是
H++A-,下列叙述不正确的是
A. 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-)
B. 0.10 mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 常温下,加入NaA固体可使HA的电离常数变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,纯水的电离度为α1,pH=3的醋酸中水的电离度为α2,pH=11的氢氧化钠溶液中水的电离度为α3。若将上述醋酸溶液和氢氧化钠溶液等体积混合,所得溶液中水的电离度为α4,则下列关系正确的是
A. α1<α3<α2<α4 B. α3<α2<α1<α4 C. α2=α3<α1<α4 D. α2=α3<α4<α1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于水解反应的是( )
A. CO32-+H2O![]() HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
C. A1O2-+HCO3-+H2O=Al(OH)3↓+CO32- D. Al3++3A1O2-+6H2O=4Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A. 取20.00mL待测盐酸溶液注入洁净的锥形瓶中并加入2~3滴酚酞试液
B. 用标准氢氧化钠溶液润洗滴定管2~3次
C. 把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管的尖嘴使之充满溶液
D. 取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E. 调节液面至“0” 或“0”刻度以下,记下读数
F. 把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、________________、F(填序号);
(2)上述B步骤的操作目的是________________。
(3)上述A步骤操作之前,若先用待测液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”、“偏小”或“无影响)。
(4)判断到达滴定终点的实验现象为________________。
(5)若滴定结束时,滴定管液面如图所示,则终点读数为_________mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.200 mol的四氧化二氮气体充入2 L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为__________%,表中c2_____c3、a_____b(填“>”、“<”或“=”)。
(2)20s时四氧化二氮的浓度c1=_________mol/L,在0 s~20 s时间段内,四氧化二氮的平均反应速率为______________mol/(L·s)。
(3)100℃时,该反应的平衡常数K = ______________________
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是_____________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com