
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示: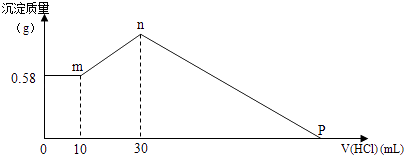
(1)混合物中NaOH的质量是g,AlCl3的质量是g.
(2)P点所表示盐酸加入体积为mL.
【答案】
(1)2.6;1.335
(2)130
【解析】解:(1)向所得浊液中,逐滴加入0.5mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:①0﹣10mL,随盐酸的体积增加,生成沉淀的质量不变,说明沉淀是Mg(OH)2 , m[Mg(OH)2]=0.58g,NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;②10mL处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;③10mL﹣30ml,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;④30mL处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml﹣10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;⑤30mL﹣P点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O、Al(OH)3+3 HCl=AlCl3+3H2O;⑥P点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液,选30mL处,计算NaOH的质量,此时溶液为NaCl溶液,溶液中Cl﹣来源于原混合物中的AlCl3、MgCl2和加入的30mlHCl,溶液中Na+来源于原混合物中的NaOH,NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,0.01mol0.02L×0.5mol/L=0.01mol由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.01mol,氯化铝的质量为:133.5g/mol×0.01mol=1.335g;由Mg原子守恒得原混合物中n(MgCl2)=n[Mg(OH)2]= ![]() =0.01mol,由Na+离子和Cl﹣离子守恒得:n(NaOH)=n(NaCl)=n(Cl﹣)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.01mol×3+0.03L×0.5mol/L=0.065mol, 所以原混合物中NaOH的质量为:m(NaOH)=0.065mol×40g/mol=2.6g,
=0.01mol,由Na+离子和Cl﹣离子守恒得:n(NaOH)=n(NaCl)=n(Cl﹣)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.01mol×3+0.03L×0.5mol/L=0.065mol, 所以原混合物中NaOH的质量为:m(NaOH)=0.065mol×40g/mol=2.6g,
故答案为:2.6;1.335;(2)液为MgCl2、AlCl3和NaCl混合液,P点所加盐酸相等于用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.065mol,
P点所表示盐酸的体积为:V= ![]() =0.13L=130mL,故答案为:130.
=0.13L=130mL,故答案为:130.
(1)先分段分析图象,分析每段图象所表示的溶液中溶质成分是什么,然后结合方程式、原子守恒求出NaOH、氯化铝的质量;(2)分析P点溶液中的溶质成分,再次结合方程式,得氢氧化钠与盐酸物质的量相等来求出盐酸的体积.


科目:高中化学 来源: 题型:
【题目】现有一定量的镁铝合金与100 mL 稀硝酸充分反应,在反应过程中无气体放出。在反应结束后的溶液中,逐滴加入1.00mol/ L NaOH溶液,加入NaOH 溶液的体积与产生沉淀的物质的量关系如图所示:
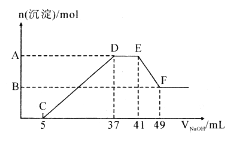
(1)合金中的铝与稀硝酸反应的化学方程式为_________;
(2)纵坐标上A 点数值是__________,B 点数值是_________;
(3)原HNO3 溶掖的物质的量浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用氯气制漂白粉的主要目的是转变为较稳定,便于贮存的物质
B. 漂白粉在空气中容易失效的原因是次氯酸钙易和空气中的水及二氧化碳反应
C. 氯原子最外层有 7 个电子,故在化学反应中易结合一个电子而形成 Cl﹣
D. 次氯酸是一种弱酸是因为次氯酸不稳定,易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或方法中,正确的是( )
A.海水淡化﹣﹣﹣﹣﹣﹣蒸馏
B.将碘单质从沙子提取出来﹣﹣﹣﹣﹣﹣﹣﹣过滤
C.盐水中获得食盐﹣﹣﹣﹣﹣﹣﹣﹣萃取分液
D.稀释浓硫酸时将水慢慢加入浓硫酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。下图是利用饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11- 0℃。
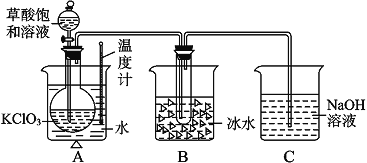
(1)配平该反应化学方程式:____KClO3+ H2C2O4== KHCO3+ ClO2↑
(2)B装置的作用是______________________ 。
(3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色。
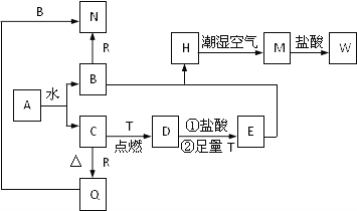
(1)写出下列物质的化学式:A:____________;E:__________。
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象:__________________。
(3)按要求写方程式:
B和R反应生成N的离子方程式:___________________________________;
M→W的离子方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的下列溶液中:①NH4Cl ②(NH4)2CO3 ③(NH4)2SO4 ④NH4HSO4 c(NH4+)由大到小的顺序是( )
A.②③①④
B.④①③②
C.③②①④
D.③②④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”下列说法不正确的是(注:炉甘石的主要成分为碳酸锌)
A.该冶炼锌的反应属于置换反应
B.煤炭中起作用的主要成分是C
C.冶炼Zn的反应方程式为:ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
D.倭铅是指金属锌和铅的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com