
 氨气的制取及性质探究(图中夹持装置均已略去).
氨气的制取及性质探究(图中夹持装置均已略去).分析 (1)N元素的原子序数为7,核外电子总数为7、核外含有2个电子层、最外层含有5个电子层;
(2)根据实验室制取氨气的原理,利用盐和碱的复分解反应确定方程式;
(3)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,可以利用湿润的红色石蕊试纸检验;
(4)利用氨气极易溶于水,形成压强差而形成喷泉进行解答;
(5)氨气溶于水,溶液体积等于氨气体积,设氨气的体积为VL,则溶液的体积为VL,根据n=$\frac{V}{{V}_{m}}$计算氨气的物质的量,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:(1)N元素的核电荷数为7,最外层为5个电子,氮元素在周期表中的位置为第二周期VA族,
故答案为:第二周期VA族;
(2)氯化铵和氢氧化钙发生复分解反应,生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,可以用湿润的红色石蕊试纸靠近烧瓶口,如果试纸变蓝,则氨气已满,
故答案为:将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,证明氨气已收集满;
(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,操作方法为:打开止水夹,挤出胶头滴管中的水,
故答案为:打开止水夹,挤出胶头滴管中的水;氨极易溶解于水,致使烧瓶内气体压强迅速减小;
(5)氨气溶于水,溶液体积等于氨气体积,设氨气的体积为VL,则溶液的体积为VL,标况下VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,故所得溶液的物质的量浓度为:c=$\frac{\frac{V}{22.4}mol}{VL}$=$\frac{1}{22.4}$mol/L,
故答案为:$\frac{1}{22.4}$.
点评 本题考查了氨气的制备和性质、物质的量浓度的计算,题目难度中等,注意掌握氨气的实验室制法及反应原理,明确形成喷泉的原理和操作方法是解答的关键.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 二氧化碳(CO2) | D. | 三氟化硼(BF3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
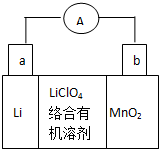 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积减小的方向移动
④有气体参加的反应平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④
B.①②③
C.②③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、I-、Cl-、SO42- | ||
| C. | NO3-、Fe3+、Cl-、I- | D. | NO3-、Cl-、Na+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 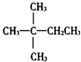 | B. | CH3CH2CH2CH2CH3 | C. | 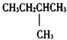 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
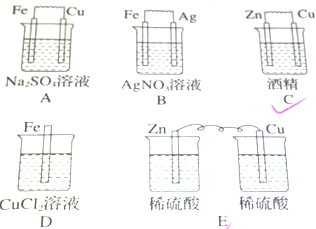
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:填空题
I.氢氧化铁胶体的制备步骤如下:
(1)用烧杯取少量蒸馏水,放在酒精灯上加热至沸腾;
(2)向烧杯中逐滴加入饱和FeCl3溶液;
(3)继续煮沸至液体是透明的红褐色,即得Fe(OH)3胶体.
回答下列问题:
①写出制备Fe(OH)3胶体的化学方程式;
②如何确定你制备的胶体是否成功?__________________________;
③若向Fe(OH)3胶体中逐滴加入H2SO4溶液会出现的现象:________________________;
II.描述下列反应的现象并写出反应的离子方程式:
①向NaHCO3溶液中加入NaHSO4溶液,现象____________________,离子方程式___________;
②向FeCl3溶液中加入NaOH溶液,现象_______,离子方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com