
【题目】下列反应可能属于吸热反应的是( )
A.甲烷与氧气反应
B.碳酸钙分解反应
C.KOH与稀硫酸反应
D.铁丝与氯气反应
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学用如图装置进行实验,下列有关说法中,正确的是( ) 
A.若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,则Y极上有气泡放出
B.若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,则溶液中Cu2+向Y极移动
C.若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,则溶液中Cu2+向Y极移动
D.若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,则 Y极上有黄绿色气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下装置探究稀盐酸中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa'处形成清晰的界面。通电后,可观察到清晰界面缓缓向上移动。下列说法不正确的是( ) 
A.通电后,可观察到清晰界面缓缓向上移动的原因是Cd2+向Pt电极迁移的结果
B.装置中Pt电极附近的pH增大
C.一定时间内,如果通过HCl溶液某一界面的总电量为5.0 C,测得H+所迁移的电量为4.1 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍
D.如果电源正负极反接,则下端产生大量Cl2 , 使界面不再清晰,实验失败
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)3﹣甲基﹣2﹣丙基﹣1﹣戊烯结构简式为 .
(2)![]() 名称为 .
名称为 .
(3)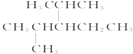 名称为: .
名称为: .
(4)![]() 名称为: .
名称为: .
(5)有机物A只由C,H,O三种元素组成,常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0g CO2和7.2g水.质谱图表明其相对分子质量为84;红外光谱分析表明A中含有﹣O﹣H和位于分子端的C H,核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1.
①写出A的分子式;
②写出A的结构简式;
③下列物质一定能与A发生反应的是(填序号)
a.H2 b.Na c.KMnO4 d.Br2
④有机物B是A的同分异构体,1mol B可以与1mol Br2加成,该有机物的所有碳原子在同一平面上,核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1,则B的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)CH3OH(g)△H<0
(1)下列情形不能说明该反应已达到平衡状态的是(填序号).
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH,CO,H2的浓度都不再发生变化
(2)CO的平衡转化率(α)与温度、压强的关系如图所示.B、C二点的平衡常数KB、KC的大小关系为 . 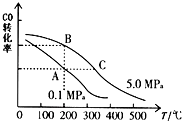
(3)某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率= , 此温度下的平衡常数K=(保留二位有效数字).
(4)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为 .
(5)已知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示。下列叙述正确的是( ) 
A.所用盐酸的浓度是0.09mol·L─1 , NaOH溶液浓度为0.03mol·L─1
B.在B点,溶液中离子浓度关系为:c(Cl─)>c(Na+)>c(OH-)>c(H+)
C.A,B,C三点水的电离程度大小依次为:A>B>C
D.滴定前,锥形瓶用待测液润洗,导致盐酸浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2 molL﹣1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 molL﹣1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 molL﹣1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3 . 用离子方程式解释现象Ⅰ: .
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42﹣ , 含有Cu+、Cu2+和SO32﹣ . 已知:Cu+![]() Cu+Cu2+ , Cu2+
Cu+Cu2+ , Cu2+![]() CuI↓(白色)+I2 .
CuI↓(白色)+I2 .
①用稀硫酸证实沉淀中含有Cu+的实验现象是 .
②通过下列实验证实,沉淀中含有Cu2+和SO32﹣ . 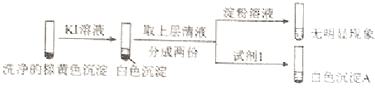
a.白色沉淀A是BaSO4 , 试剂1是 .
b.证实沉淀中含有Cu+和SO32﹣的理由是 .
(3)已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42﹣ , 该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和 .
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一:
步骤二:(按图形式呈现).
b.假设ii成立的实验证据是
(4)根据实验,亚硫酸盐的性质有 . 盐溶液间反应的多样性与有关.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻 璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如下: 
(1)写出第①步反应的离子方程式。
(2)洗涤滤渣B的目的是为了除去(填离子符号),检验该离子是否洗净的方法是。
(3)写出第③步反应的化学方程式。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经、、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为86%)1.000g,加硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com