
��֪������������ճ������м�Ϊ��������,��һ��������,CH3COOH��Һ�д��ڵ���ƽ��:CH3COOH CH3COO-+H+����H>0��
CH3COO-+H+����H>0��
(1)������,��pH=5��ϡ������Һ��,c(CH3COO-)=����������������������(��ʽ,���ػ���);���з�����,����ʹ0.10 mol��L-1 CH3COOH�ĵ���̶���������������� ��
a.��������0.10 mol��L-1��ϡ����
b.����CH3COOH��Һ
c.��ˮϡ����0.010 mol��L-1
d.��������������
e.���������Ȼ��ƹ���
f.��������0.10 mol��L-1��NaOH��Һ
(2)����������пͶ��������pH������3�Ĵ����������Һ��,������ַ�Ӧ��,����ֻ��һ����Һ����п��ʣ��,���������������:V(����)��������V(����),��Ӧ���������Ϊ:v(����)��������v(����)(����>������<������=��)��
(3)������,�����ΪVa mL,pHΪ3�Ĵ�����Һ�еμ�pH=11��NaOH��ҺVb mL����Һǡ�ó�����,��Va��Vb�Ĺ�ϵ������������������������������
(4)������,��0.1 mol/L�����0.1 mol/L��������Һ���,������ҺΪ����,������Һ�и����ӵ�Ũ�Ȱ��ɴ�С����Ϊ�� ��
(5)��֪:90 ��ʱ,ˮ�����ӻ�����ΪKW=3.8��10-13,�ڴ��¶���,��pH=3�������pH=11������������Һ��������,������Һ�е�c(H+)=������������������(������λ��Ч����) mol/L��
(1)(10-5-10-9) mol/L��bcf
(2)<��=��(3)Va<Vb
(4)c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-)
(5)2.05��10-11
��������(1)��pH=5��ϡ������Һ��,c(H+)=10-5 mol/L,����ˮ�ĵ���ƽ�⼰����ĵ���ƽ�ⷽ��ʽCH3COOH H++CH3COO-���Կ���,c(CH3COO-)=c(H+)��Һ-c(H+)ˮ=(10-5-10-9) mol/L;���ȡ���ˮϡ�͡�����������ʾ���ʹ����ƽ�������ƶ�,��ѡbcf��
H++CH3COO-���Կ���,c(CH3COO-)=c(H+)��Һ-c(H+)ˮ=(10-5-10-9) mol/L;���ȡ���ˮϡ�͡�����������ʾ���ʹ����ƽ�������ƶ�,��ѡbcf��
(2)����������,�������pH,��n(CH3COOH)>n(HCl),��������п��ʣ��,�������ͽ����ķ�Ӧ,����ƽ�ⲻ�ϵ������ƶ�,�����������������,���Դ����������������ϴ�,��ʼʱ,����������pH������3,����ʼʱ�����ӵ�Ũ�����,���Կ�ʼʱ��������ȡ�
(3)����������,pHΪ3�Ĵ�����Һ��,CH3COOH��Ũ�ȴ���10-3 mol/L,pH=11��NaOH��ҺŨ�ȵ���10-3 mol/L,�����Һǡ�ó�����,˵�������,����Va<Vb��
(4)���ݵ���غ�:c(CH3COO-)+c(Cl-)+c(OH-)=c(Na+)+c(H+),��ҺΪ����,����֪��c(CH3COO-)+c(Cl-)=c(Na+),����c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-)��
(5)pH=3��������c(H+)=10-3 mol/L,pH=11������������Һ��:c(OH-)=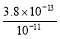 =38��10-3 mol/L,��Ϻ��ʣ��,ʣ�����������Ũ��Ϊ:c(OH-)=
=38��10-3 mol/L,��Ϻ��ʣ��,ʣ�����������Ũ��Ϊ:c(OH-)=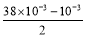 =0.018 5 mol/L,
=0.018 5 mol/L,
����c(H+)=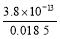 mol/L��2.05��10-11 mol/L��
mol/L��2.05��10-11 mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦѡ����ר�� NA��Ӧ����ϰ���������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ,����������ȷ���ǣ��� ����
A.1 mol�ǻ���17 g NH3������������ΪNA
B.12.4 g���ף�����ʽΪP4���к���P��P���ۼ�0.6NA
C.��⾫��ͭ�Ĺ�����,ÿת��NA������ʱ,�����ܽ�ͭ������Ϊ32 g
D.����ͭ���ܽ���1 L 0.5 mol/Lϡ������,������2.24 L NOʱ,��Һ�е�ԭ����Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ�ۺ���ר�� ��ѧ��Ӧԭ����ϰ���������棩 ���ͣ������
���ǵ�ѭ�������е���Ҫ����,���ĺϳ���Ŀǰ�ձ�ʹ�õ��˹��̵�������
(1)����ͼ1�ṩ����Ϣ,д���÷�Ӧ���Ȼ�ѧ����ʽ:��������������������������������������������,��ͼ1��������������������(�a����b��)��ʾ��������ý�������仯���ߡ�
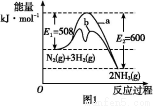
(2)�ں���������,������������˵��������Ӧ�Ѵ�ƽ���������������
A.3v(H2)��=2v(NH3)��
B.��λʱ��������n mol N2��ͬʱ����2n mol NH3
C.���������ܶȲ��ٸı�
D.������ѹǿ����ʱ��ı仯���仯
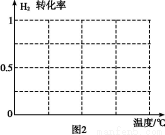
(3)һ���¶���,��2 L�ܱ������г���1 mol N2��3 mol H2,�����������,0.5 min��ﵽƽ��,�����������0.4 mol NH3,��ƽ����Ӧ����v(N2)=������������,���¶��µ�ƽ�ⳣ��K=�����������������������¶�,Kֵ�仯��������(���������С�����䡱)��
(4)Ϊ��Ѱ�Һϳ�NH3���¶Ⱥ�ѹǿ����������,ijͬѧ���������ʵ��,����ʵ�������Ѿ���������ʵ����Ʊ��С�
ʵ���� | T(��) | n(N2)/n(H2) | p(MPa) |
�� | 450 | 1/3 | 1 |
�� | �� | �� | 10 |
�� | 480 | �� | 10 |
A.�����ϱ��ո�������ʣ���ʵ���������ݡ�
B.���ݷ�ӦN2(g)+3H2(g) 2NH3(g)���ص�,�ڸ���������ͼ2��,��������1 MPa��10 MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ,�������������ߵ�ѹǿ��
2NH3(g)���ص�,�ڸ���������ͼ2��,��������1 MPa��10 MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ,�������������ߵ�ѹǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ѡ��2��ѧ�뼼����ϰ���������棩 ���ͣ������
��������к���Cr(OH)3��Al2O3��ZnO��CuO��NiO������,��ҵ��ͨ�������±�������������������Na2Cr2O7�����ʡ�
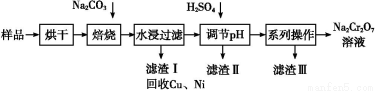
��֪:��Na2CrO4��Һ�к�������NaAlO2��Na2ZnO2������
(1)ˮ�������Һ������������(������������������������)��
(2)����������չ���������Na2CrO4�Ļ�ѧ����ʽ��
��������Cr(OH)3+��������Na2CO3+������������ ��������Na2CrO4+��������CO2+������������
��������Na2CrO4+��������CO2+������������
(3)����������Ҫ�ɷ���Zn(OH)2������������
(4)��ϵ�в�������Ϊ:��������H2SO4,��������,��ȴ�ᾧ,���ˡ���������H2SO4Ŀ������ ��
��֪:����ȥ����II��,��Һ�д������·�Ӧ:
2CrO42��+2H+ Cr2O72��+H2O
Cr2O72��+H2O
��Na2Cr2O7��Na2CrO4�ڲ�ͬ�¶��µ��ܽ�����±�
�¶� �ܽ�� ��ѧʽ | 20 �� | 60 �� | 100 �� |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
Na2CrO4 | 84 | 115 | 126 |
(5)��ҵ�ϻ�������ˮ�����˺����Һ(Na2CrO4)��������H2SO4,��ʯī���缫�������������,д�����ɸ��ĵ缫��Ӧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ѡ��2��ѧ�뼼����ϰ���������棩 ���ͣ�ѡ����
����ʹ�û��ʡ�ũҩ����������ȷ����(����)
A.���¶���ʱ�Ƚ��ʺ�ʩ�üط�
B.����ʩ����炙�����������
C.ʯ��ϼ������������Ϻ����ʩ��
D.��ľ�ҿ��Ժ��̬����һ��ʩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ר��9��Һ�еĵ���ƽ����ϰ���������棩 ���ͣ�ѡ����
����ʱ,��V1 mL c1 mol��L-1�İ�ˮ�μӵ�V2 mL c2 mol��L-1��������,������������ȷ����(����)
A.�������Һ��pH=7,��c1V1>c2V2
B.��V1=V2,c1=c2,����Һ��c(N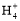 )=c(Cl-)
)=c(Cl-)
C.�����Һ��pH=7,����Һ��c(N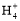 )>c(Cl-)
)>c(Cl-)
D.��V1=V2,�һ��Һ��pH<7,��һ����c1<c2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ר��8��ѧ��Ӧ�����뻯ѧƽ����ϰ���������棩 ���ͣ������
2013���,�������������Ű�ҹ��ж�������������,����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
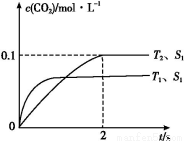
(1)����β����������Ҫԭ��Ϊ:2NO(g)+2CO(g) 2CO2(g)+N2(g)�����ܱ������з����÷�Ӧʱ,c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯����,��ͼ��ʾ��
2CO2(g)+N2(g)�����ܱ������з����÷�Ӧʱ,c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯����,��ͼ��ʾ��
�ݴ��ж�:
���÷�Ӧ����H����0(����>������<��)��
����T2�¶���,0��2 s�ڵ�ƽ����Ӧ����v(N2)=����������
�����������������һ��ʱ,���������������ѧ��Ӧ���ʡ��������ı����S1>S2,����ͼ�л���c(CO2)��T1��S2�����´ﵽƽ������еı仯���ߡ�
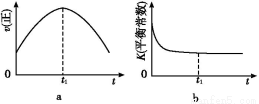
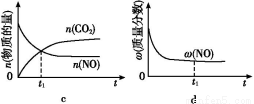
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н���,����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬������������(�����)��
(2)ֱ���ŷ�úȼ�ղ������������������صĻ������⡣
��úȼ�ղ���������������������,��CH4����ԭNOx�������������������Ⱦ��
����:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ��H1=-867 kJ/mol
N2(g)+CO2(g)+2H2O(g) ��H1=-867 kJ/mol
2NO2(g) N2O4(g) ��H2=-56.9 kJ/mol
N2O4(g) ��H2=-56.9 kJ/mol
д��CH4(g)����ԭN2O4(g)����N2(g)��H2O(g)���Ȼ�ѧ����ʽ:�� ��
����ȼú�����Ķ�����̼��������,�ɴﵽ��̼�ŷŵ�Ŀ�ġ���ͼ��ͨ���˹��������,��CO2��H2OΪԭ���Ʊ�HCOOH��O2��ԭ��ʾ��ͼ������b���淢���ĵ缫��ӦʽΪ�� ��
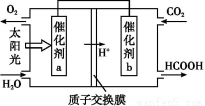
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ר��7Ԫ�����ڱ���Ԫ����������ϰ���������棩 ���ͣ�ѡ����
����5�ֶ�����Ԫ��X��Y��Z��Q��W,ԭ��������������,�����ڱ���Xԭ�Ӱ뾶��С;X��Wͬ����;YԪ��ԭ�Ӻ�������������������������3��;QԪ���ǵؿ��к�����ߵ�Ԫ�ء�����˵������ȷ����(����)
A.ԭ�Ӱ뾶:Y<Q<W
B.ZX3��ʹ��ɫʯ����Һ����
C.X��Z��Q 3��Ԫ�ؿ�������ӻ�����ۻ�����
D.X2Q2��Y2X6 2�ַ����к��еĵ���������ѧ�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ר��4������ԭ��Ӧ��ϰ���������棩 ���ͣ�ѡ����
��Cu2S+2Cu2O 6Cu+SO2����Ӧ��,����˵������ȷ����(����)
6Cu+SO2����Ӧ��,����˵������ȷ����(����)
A.Cu2O�ڷ�Ӧ�б�����
B.Cu2S�ڷ�Ӧ�м������������ǻ�ԭ��
C.Cu���������������ǻ�ԭ����
D.����Ӧ��ת��12 mol����,������6 mol Cu
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com