
用惰性电极电解物质的量浓度相同、体积比为1:3的CuSO4和NaCl的混合溶液,可能发生的反应有()
①2Cu2++2H2O 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl﹣ Cu+Cl2↑
Cu+Cl2↑
③2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑
2OH﹣+H2↑+Cl2↑
④2H2O 2H2↑+O2↑
2H2↑+O2↑
A. ①②③ B. ①②④ C. ②③④ D. ②④
考点: 电解原理.
专题: 电化学专题.
分析: 用惰性电极电解物质的量浓度之比为1:3的CuSO4和NaCl的混合溶液,电解过程分为:
第一阶段,阳极上氯离子放电、阴极上铜离子放电;
第二阶段:阳极上氯离子放电,阴极上氢离子放电;
第三阶段:阳极上氢氧根离子放电,阴极上氢离子放电.
解答: 解:用惰性电极电解物质的量浓度之比为1:3的CuSO4和NaCl的混合溶液,设溶液体积为1L,硫酸铜浓度为1mol/L,氯化钠浓度为3mol/L,则n(CuSO4)=n(Cu)=1mol,n(NaCl)=n(Cl﹣)=3mol,
根据转移电子守恒,第一阶段:阳极上氯离子放电,阴极上铜离子放电,当铜离子完全析出时转移电子的物质的量为2mol,转移2mol电子时析出2mol氯离子,所以氯离子还剩余1mol,则此时发生的电池反应式为②;
第二阶段:阴极上氢离子放电,阳极上氯离子放电,当氯离子完全析出前,发生的电池反应式为③;
第三阶段:阴极上氢离子放电,阳极上氢氧根离子放电生成氧气,所以发生的电池反应式为④;
故选:C.
点评: 本题考查了电解原理,明确离子放电顺序是解本题关键,结合转移电子相等判断阴阳极上析出的物质,难度中等.


科目:高中化学 来源: 题型:
已知Ksp(AgCl)=1.56×10﹣10,Ksp(AgBr)=7.7×10﹣13,Ksp(Ag2CrO4)=9.0×10﹣12.某溶液中含有Cl﹣、Br﹣和CrO42﹣浓度均为0.010mol•L﹣1,向该溶液中逐滴加入0.01 0mol•L﹣1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()
0mol•L﹣1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()
A. Cl﹣、Br﹣、CrO42﹣ B. CrO42﹣、Br﹣、Cl﹣
C. Br﹣、Cl﹣、CrO42﹣ D. Br﹣、CrO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
2H2O(l)=2H2(g)+O2(g);△H1=+571.6kJ/mol,
2H2(g)+O2(g)=2H2O(g);△H2=﹣483.6kJ/mol.
当1g 液态水变成气态水时,对其热量变化的下列描述:
①放出;②吸收;③2.44kJ;④4.88kJ;⑤88kJ,
其中正确的是()
A. ②和⑤ B. ①和③ C. ②和④ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯.在电解精炼时()
A. 粗铜接电源负极
B. 纯铜作阳极
C. 杂质都将以单质形式沉积到池底
D. 纯铜片增重2.56g,电路中通过电子为0.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L﹣1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是()
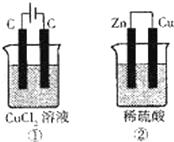
A. 产生气体的体积:①>②
B. 两极上析出物质的质量:①>②
C. 溶液的pH变化:①增大,②减小
D. 电极反应式:①中阳极:4OH﹣﹣→2H2O+O2↑+4e﹣;②中阴极:2H++2e﹣﹣→H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
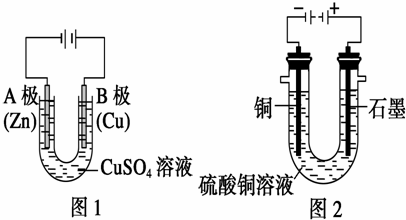
请按要求回答下列问题.
(1)根据图1回答①②:
①A电极可观察到的现象是 物质,电极反应式为 ;B极的电极反应式为 .
②通电一段时间后,CuSO4溶液的浓度 ,pH (填“变大”、“变小”或“不变”).
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为 ,电解反应的离子方程式为 .
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积 .
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积的变化关系如图所示。下列说法不正确的是( )
A.Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时,有:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(NH4+)=c(Cl-)
C.滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.当滴定氨水消耗V(HCl)=10 mL时,有:2=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com