
【题目】I、在一定条件下的下列可逆反应达到平衡时,试填出:x A+y B![]() z C
z C
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是________;
(2)若C是气体,并且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向_____方向移动;
(3)已知B、C是气体,现增加A物质的量,平衡不移动,说明A是______(填状态);
(4)如加热后,C的百分含量减小,则正反应是________热反应。
II、如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2mol Y,起始时,V(A)=V(B)= a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g) ΔH<0。达到平衡时,V(A)= 1.2a L。
2Z(g)+W(g) ΔH<0。达到平衡时,V(A)= 1.2a L。
试回答:
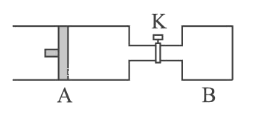
(1)A中X的转化率α(A)___________________________。
(2)A、B中X的转化率的关系:α(A) ___________α(B)。(填“<”“>”或“=”)
(3)打开K,一段时间又达到平衡,A的体积为___________L。(连通管中气体体积不计)
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如右图所示,则8分钟内CO的平均反应速率v(CO)=______。

(2)写出该反应平衡常表达式:K=__________;下列措施中能使该反应的平衡常数K增大的是____(填序号)。
A.升高温度 B.增大压强 C.充入CO D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将______ (填“增大”、“减小”、“不变”)。
(4)铁的重要化合物在生产生活中应用十分广泛。
①高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为____________。
②高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述错误的是____(填序号)。
A.放电时每转移6mol电子,负极有2mol K2FeO4被还原
B.充电时阴极反应为:Zn(OH)2 +2e-=Zn+ 2OH-
C.放电时正极反应为:FeO42-+ 3e-+ 4H2O= Fe(OH)3+ 5OH-
D.充电时阳极附近溶液的碱性减弱
(5)已知:2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ/mol
2H2(g)+ O2(g)= 2H2O(g);△H=-483.6 kJ/mol
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在溶液中大量共存的一组离子是( )
A.Cu2+、SO42-、OH—、K+B.Na+、CO32-、H+、Cl-
C.H+、Cl-、NO3-、Ba2+D.Ca2+、H+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
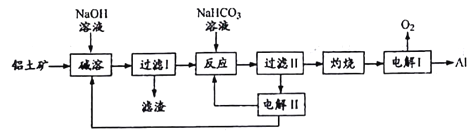
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为____________。
(2)向“过滤I”所得滤液中加入NaHCO3溶液,溶液的PH_____(填“增大”、“不变”或“减小”),NaHCO3中存在化学键有______
(3)“电解I”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是________。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。

阳极的电极反应式为_______,阴极产生的物质A的化学式为_______。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
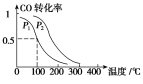
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
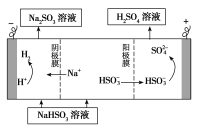
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极)
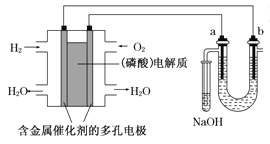
(1)电池工作时,正极的电极反应式为_______________,NaOH溶液试管中发生的主要反应为(用离子方程式表示)______________,电池中若消耗3.36L气体(标准状况)时,b电极周围产生____mol气体。
(2)若将该电池改为甲醇(CH3OH)燃料电池,电解质溶液为KOH,则其负极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为海水利用的部分过程。下列有关说法正确的是
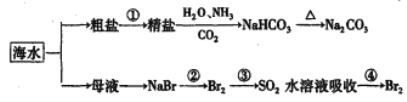
A. 粗盐提取精盐的过程只发生物理变化
B. 用澄清的石灰水可鉴别Na2CO3产品是否含有NaHCO3
C. 在第②、④步骤中,溴元素均被还原
D. 制取NaHCO3的反应是利用其溶解度小于NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:4Al(s)+3O2(g)=2Al2O3(s) △H=-3350kJ·mol-1
2Fe(s)+O2(g)=2FeO(s) △H=-544kJ·mol-1
则2Al(s) +3FeO(s)=Al2O3(s) + 3Fe(s)的△H是( )
A. +1403 kJ·mol-1 B. -859 kJ·mol-1
C. -1718 kJ·mol-1 D. -2806kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com